理科のこと、環境ニュース
ちっちゃな鏡作り
有機化学のアルデヒドの項では、アルデヒドには還元性があり、この還元性は銀鏡反応やフェーリング液の反応で確認できることを学びます。
この銀鏡反応ですが、全く文字通り試験管の内側に銀がキレイに付着して鏡のようになる反応です!
でも見てるだけじゃツマラナイので、持ち帰れる小さな鏡を作ってしまおう! という実験を先日行いました。
単体金属の銀をガラス面均一に析出させるために、銀アンモニア錯イオンを作っておいてこれにブドウ糖水溶液を混ぜます。
ブドウ糖は3種の異性体の混合物として存在しているんですが、これら異性体のうち1つにアルデヒド基(ホルミル基)があり、このアルデヒド基の還元性によって銀のイオンが銀に還元されて析出するという仕組みです。
錯イオンの形態の銀イオンを使っていますが、基本的な考えは
Ag+ + eー → Ag
ということですね。
ガラス面にキレイに銀を析出させるには、Ag+より[Ag(NH3)2]+が適しているということなんです。
ちなみに銀の電解メッキ工場では、[Ag(CN)2]ーを使うので、この原料である猛毒の青酸カリ(KCN)の話題が出てくる訳です。
さて、鏡づくりですが・・・

キレイな鏡を作るための工夫だと思いますが、塩化スズSnCl2を補助剤として使っています。
スズイオンはSn2+よりSn4+の方が安定なので、SnCl2は還元剤として働きます。
つまりここでのSnCl2はブドウ糖と共に銀イオンを還元していることになります。
ガラスですが、スライドガラスを流用してまずはこのように細工しておきます。
銀がガラス片面だけに析出するようにするためです。
銀アンモニア錯イオン溶液は、硝酸銀溶液にアンモニア水を加えていくだけで作れます。
硝酸銀溶液にアンモニア水を少量加えると酸化銀Ag2Oの褐色沈殿が生じます。
2Ag+ + 2OHー → Ag2O↓ + H2O
このあと、この酸化銀の濁りがちょうど消えるところまでさらにアンモニア水を加えていくと、
銀はすべて銀アンモニア錯イオン[Ag(NH3)2]+ に変化し透明溶液となります。
Ag2O + 4NH3 + H2O → 2[Ag(NH3)2]+ + 2OHー
これ以上アンモニア水を入れると銀鏡反応の感度が落ちるので、入れ過ぎないように注意します。
すみません! この後の途中経過の写真がないんですが、仕上がった鏡はこんな感じになりました。
そしてこれは、自分が慌ててテキトーな操作で使った失敗作!(笑)
これじゃあ全然ダメですね・・・
この実験は原理はシンプルなんですが、随所に「コツ」が必要なんですね!
最後に実験後の片づけでの注意点があります。
この実験では、不安定な雷銀という爆発性の物質が生じやすくなっています!
これを避けるために実験後の廃液は食塩水と混ぜて処理します。
銀イオンが食塩水と混ざることで安定な塩化銀AgClが生じるので、この状態の廃液としてから処理業者に引き取ってもらうようにします。
室内火災発生! CO中毒から命守るには?
一酸化炭素(CO)中毒から命を守るためにはどうすればいいのか。
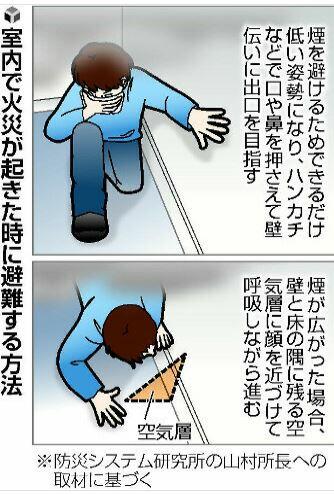
「室内で火災が起きた時は、とにかく低い姿勢になり、出口へと急いでほしい」
火災が発生した室内では、煙が充満する。
視界が遮られるだけでなく、COや炭素の粒子を吸い込むことで呼吸ができなくなる。
このため、出火に気づいた際には煙を避けるため、
できるだけ低い姿勢になり、ハンカチやタオル、衣服などで口や鼻を押さえて壁伝いに避難することが大切だ。
煙が広がった場合は、空気層が残る壁と床の隅に顔を近づけて呼吸しながら逃げることも考える。
COを除去する効果は、ハンカチなどを水でぬらしても期待できないという。
「気道の熱傷を防ぐ効果はあるが、よほど炎に近い場所でなければ意味がない」
「ハンカチをぬらす時間があれば、まずは逃げてほしい」
リチウムイオン電池火災が急増 昨年上回るペース
リチウムイオン電池の発火事故は、民生機だけでなく、さらに信頼性を求められる業務用産業用の機器などでも起きてきました。
最近は改良が重ねられ、発火事故は激減したのではないかと思います。
しかし、活性が極めて強いリチウムを使う電池ですから、元々危険性を持っているということなのです。
枕もとのスマホ、職場に置いてあるモバイルバッテリー、家族に贈ったブルートゥーススピーカー・・・
これらが、夜、留守にしている時、日射を受けて高温になっている時、等々・・・
発火する恐れがないか、いつも気になっているんです。
「取り扱いに気を付けなければならない電池」である、ということを気に留めておくべきだと思います!
最近の、以下の記事を読んでみて下さい。
ここでは、純正以外の規格外の充電器を使って起きた事故が紹介されています。
スマホなど携帯端末に使われるリチウムイオン電池から出火する火災が都内で相次いでいる。
昨年を上回るペースとなっているため、東京消防庁が注意を呼びかけている。
同庁によると、製品別の内訳では、
①モバイルバッテリー20件
②スマホ等携帯電話14件
③コードレス掃除機7件
の順に多かった。
リチウムイオン電池が原因の火災は近年増加している。
5月に都内の住宅であった火災では、リチウムイオン電池を使う電動モップに他社製の充電器を用いたところ出火し、2人がけがをしたという。
東京消防庁は「メーカー指定の純正品を使い、充電中に熱くなるなどの異常があった際は使用をやめてメーカーや販売店に相談してほしい」としている。
電気分解の実験
机上で勉強したことが、実際はどういった変化となって、見たり匂いを嗅いだりして実感することが出来るのか?
こういうことを体験できるのが実験という訳なんですが、実験を行う時は操作も簡単で、実験している人が「あーそうだよな!」と実感出来るやり方を確立させなければいけません。
そこで、実験書やWeb情報など活用して調べるんですが、最終的な現場(実験室)での知恵もすごく重要になると思っています!
現任校の実験についてなんですが、実験方法がとても良く考えられていて、改良も随所に施されていることをいつも実感しているんです!
今回は電気分解の実験を4種類行いましたが、生徒たちにとって結果も分かりやすく実感できたのではないかと思っています。
まずは、塩化銅(Ⅱ)CuCl2 水溶液の電気分解です。
この溶液中では、CuCl2 が Cu2+ と Clー に電離して、これらのイオンが水中を漂っています。
そしてこれらのイオンが各電極に引き寄せられ、次のような反応が起こります。
陽極(+) 2Clー → Cl2 ↑ + 2eー (気体の塩素が発生)
陰極(ー) Cu2+ + 2eー → Cu (金属銅が析出)
こんな感じですね!
これを実感できる実験ですが、下を見て下さい。
この006P乾電池(懐かしい!)を使えばワンタッチで電圧をかけられますし、配線も不要ですね。
また、この細い紙はヨウ化カリウムでんぷん紙という酸化力のある物質を検出する試験紙です。
この実験ならピンセットではなく指先でつまむ操作で充分でしょう。
とても分かりやすい結果が確認出来ていますね!
陰極には赤っぽい金属銅が付着していますし、陽極から発生した塩素ガスの酸化作用によってヨウ化カリウムでんぷん紙が青紫色に変色しています。
塩素ガスは臭いでも確認出来ていましたが、発生した量はごく僅かで問題は起きませんでした。
次は、ヨウ化カリウム KI 水溶液の電気分解です。
この溶液中では、 KI が K+ と Iー に電離してこれらのイオンが水中を漂っています。
陽極(+) 2Iー → I2 + 2eー (固体のヨウ素が析出)
陰極(ー) H2O + 2eー → 2OHー + H2 ↑ (気体の水素が発生)
こんな感じです。
陰極では気体の水素が気泡となっていますし、このあと陰極付近にフェノールフタレイン溶液をたらすと、ピンク色(赤色と覚えて下さい)に変色しOH-の生成が確認出来ます。
一方の陽極では、固体のヨウ素I2が生じたあとすぐに水中のヨウ化物イオンIーと結合してI3-となり、このために褐色となるのです。
I2だけなら濃い紫色が現れるはずですね。
このようなシンプルな実験器具なんですが、炭素棒を固定するセパレーター、試験用の指示薬や溶液を入れたプラスチック製の小容器、時間を測る小さな電子式ストップウォッチなど、毎回の実験で有難さを感じる細かい配慮がなされているんです。
いつも有難うございます!!
異種金属間に生じる電位差の実験
金属は陽イオンになりやすく、金属が陽イオンになる時に電子を押し出します。
金属によってこの電子を押し出す強さが異なるので、2つの異種金属を電解質溶液に浸すと、これら2つの金属電極に電位差が生じることになります。
この電位差が電池の起電力に相当します。
食塩水で湿らせたろ紙の上に、亜鉛Zn、鉄Fe、銅Cu、マグネシウムMg、
の4つの金属を置き、デジタルマルチメーターで電圧を測定する実験を行いました。
デジタルマルチメーターですが、今回使用したのはそれほど高価なものではないそうですが、この実験には性能的に充分なようです。
旧式のアナログ電圧計だと、内部抵抗がそれほど大きくないので電圧が上手く測定できないと思います。
今回の実験での測定値は小数点以下3ケタも表示してありますが、実験方法がややラフだったこともあり、測定値はそれほど正確ではありません。
まあ、おおよその傾向は読み取れたと思います!
このウェブサイトは、
NetCommons3.3.7で動いています。
NetCommons プロジェクト 開発の、
CMS+グループウェアです!
| 日 | 月 | 火 | 水 | 木 | 金 | 土 |
27 1 | 28 1 | 29 | 30 | 31 | 1 | 2 |
3 | 4 | 5 | 6 | 7 | 8 | 9 |
10 | 11 | 12 | 13 | 14 | 15 | 16 |
17 | 18 | 19 | 20 | 21 | 22 | 23 |
24 | 25 | 26 | 27 | 28 | 29 | 30 |