2020年12月の記事一覧
カーボンリサイクルで二酸化炭素を燃料に?!
「カーボンリサイクル」と聞けば、炭素の再利用だろうと考えます。
人間が利用しているエネルギーの大部分は、石油などの化石燃料を燃やすことで得ています。
「カーボンリサイクル」とは、その結果で生じる二酸化炭素を再利用する技術ですね。
そのリサイクルのうち、「プラスチックのような炭素化合物の原料に二酸化炭素を使う」といったようなことは可能なんだろうなと思います。
ところが、「エネルギーを放出して出来た二酸化炭素を燃料に利用する」と聞けば、ちょっと信じられない驚きを感じます!
でも良く考えてみれば、植物にはそれが出来ているんですよね!
光合成による炭酸同化作用です。
二酸化炭素と水から、酸素と炭水化物を生産している訳ですが、光エネルギーを得ながらこの反応を起こしています。
この結果、生じた炭水化物は光からのエネルギーを蓄えたもの、つまり燃料として利用できるものとして出来上がっている訳です!
人工的にこの光合成を真似することが未だに出来ない訳ですが、このような反応が他にもあるのではないだろうか・・・
地球温暖化の原因になっているといわれるCO2の排出量を減らすことは、今やグローバルな課題になっています。
エネルギー分野においては、CO2排出量の少ないエネルギー資源への転換をはかること、省エネルギーに努めることなどが大切です。
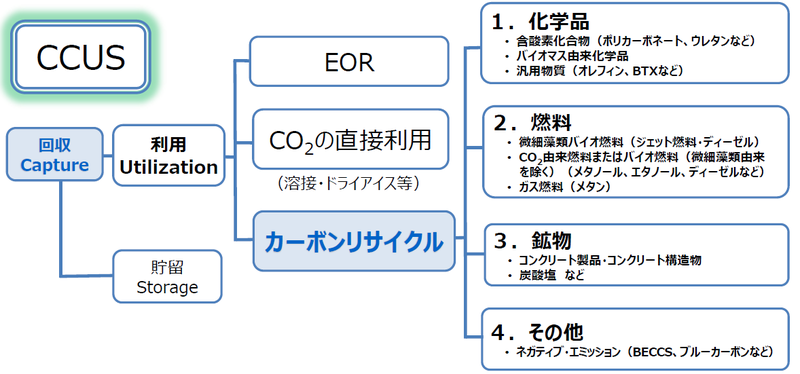
加えて、CO2を分離・回収して地中に貯留する「CCS」、分離・回収したCO2を利用する「CCU」も、大気中のCO2を削減するための重要な手法として研究が進められています。
このようなCO2の利用をさらに促進するべく、研究開発をイノベーションにより進めようという取り組みが、「カーボンリサイクル」です。
CCUでこれまで一般的だったのは、「EOR(原油増進回収技術)」と呼ばれる手法への利用です。
たとえば、油田にある原油をできるだけ回収するためには、水などを、圧力をかけて注入し、岩石の小さな穴などに溜まっている原油を押し流します。この時、水の代わりに炭酸ガスを圧入するのが、CO2を使ったEORです。
もうひとつ、現在一般的なCO2の利用先としては、ドライアイスや溶接などに直接利用する方法があります。
しかし、こうした方法だけでは、利用されるCO2の量は限られてしまいます。
そこで、CO2を“資源”ととらえ、素材や燃料に再利用することで大気中へのCO2排出を抑制する、そのために世界の産学官連携のもとで研究開発をおこないイノベーションを進めていこうとする取り組みが、経済産業省が提唱する「カーボンリサイクル」です。
CO2の利用先としては、①化学品、②燃料、③鉱物、④その他が想定されています。
①化学品では、具体的には、ウレタンや、プラスチックの一種でCDなどにも使われるポリカーボネートといった「含酸素化合物」が考えられています。
また、バイオマス由来の化学品や、汎用的な物質であるポリプロピレンやポリエチレンなどの樹脂も利用先となりえます。
②燃料では、光合成をおこなう小さな生き物「微細藻類」を使ったバイオ燃料や、バイオマス由来のバイオ燃料がCO2の利用先として考えられています。
③鉱物では、「コンクリート製品」や「コンクリート構造物」が考えられています。
具体的には、コンクリート製品などを製造する際に、その内部にCO2を吸収させるものなどです。
④その他として、バイオマス燃料とCCSを組み合わせる「BECCS」、海の海藻や海草がCO2を取り入れることで海域にCO2が貯留する「ブルーカーボン」などが考えられています。
これらは総称して「ネガティブ・エミッション」と呼ばれます。
新型コロナウィルス等の殺菌用LEDを開発、量産へ
発光ダイオ―ド(LED)製造大手の日亜化学工業は、LEDで紫外線を照射して新型コロナウイルスを不活化して殺菌にも利用できる装置を開発したと発表した。
空気清浄機やエアコンなど家電の内部に取り付けたり、紙類などの消毒に活用できたりする可能性がある。
ただし、人体への影響を考慮すると、肌に直接照射することは困難という。
二酸化炭素は「無毒」と教わりますが、実は怖い中毒も!
昨日12月22日午前、名古屋市のホテル地下駐車場で、充満した煙を吸うなどして、作業員と周辺の方11人が病院に搬送され、このうち50代の男性作業員が死亡しました。
二酸化炭素を発生させる消火設備が作動し、煙が充満したとみられています。
この消火設備は二酸化炭素を注入することで酸素の濃度を16%以下にし火を消す仕組みです。
二酸化炭素の消火設備は、スプリンクラーで水をかけられない、主にコンピューターなど電気設備のある場所で使われていて、火災報知機と連動して自動で動くものもあるといいます。
一方、二酸化炭素は人体に悪影響を及ぼす可能性があるため、最近は窒素などで代用されることが多いといいます。
この事件では、不幸なことに犠牲になられた方が出てしまいました。
そして、この報道中にもある「酸欠とは別の二酸化炭素の有害性」について、過去の事故を思い出したので記しておこうと思います。
1997年7月12日夜、青森県八甲田山のくぼ地で、訓練中の自衛隊員3人が死亡する事故が起きた。
死因は、火山性の二酸化炭素ガスと見られている。
コーラやビールの気泡やドライアイスなど、身近な存在でもある二酸化炭素。
実は、人間や動物をあっという間に倒す怖い一面を持っている。
しかし、毒性の仕組みはまだ良く分かっていない。
どんな条件の時、二酸化炭素の中毒は起きるのか。
事故の翌日、現地のガス成分を調べた報告書によると、くぼ地での二酸化炭素濃度は15~20%だった。
大気中の二酸化炭素濃度は約0.03%なので、このくぼ地では、通常の約500倍もの濃度があったことになる。
二酸化炭素が原因だとすると、自衛隊員らが倒れたのは酸素が欠乏したせいか?
それとも高濃度の二酸化炭素そのもののせいだろうか?
命にかかわる酸素欠乏は、空気中の酸素濃度が12%を下回った時と言われている。
二酸化炭素濃度が20%の時の酸素濃度は16.7%で、致命的な酸欠状態とは言えない。
一方、一般的に二酸化炭素を30分間吸い続けても後遺症がない「脱出限界濃度」は5%とされている。
10%の二酸化炭素を吸うと、耳鳴りやふるえが起き、1分間で意識を失う。
30%になると、即座に意識不明の状態になる。
酸素20%、二酸化炭素80%の気体を犬に吸わせたら、1分で呼吸が止まり、数分で死亡したという報告があるという。
この実験は、大気と同じ濃度の酸素(大気の酸素濃度は約20%)があっても、二酸化炭素が一定量以上あれば、中毒を起こすことを示している。
1986年8月、西アフリカ・カメルーンでは、湖から火山性の二酸化炭素ガスが大量に噴出、湖の近くで、村人約1200人のほぼ全員が死亡する事故が起きている。
火山性ガス以外では、車でドライアイス運搬中にドライアイスが気化して中毒を起こした例や、二酸化炭素消火装置による例などがある。
ドライアイス2キログラムは、室温だと1時間で約350グラムが気化して約200リットルの二酸化炭素になる。
車内空間が約2立方メートルの軽自動車の場合、濃度は約10%になり、密室状態にしておくと中毒を起こす条件になる。
ドライアイス販売会社は「車で持ち帰るお客さんには、窓を開けて運転するよう呼びかけています」と言う。
二酸化炭素ガスにすばやく意識を奪う作用があることは、18世紀にはすでに分かっていたが、なぜそのような効果があるのか、仕組みはいまだに解明されていない。
大阪大学医学部麻酔学の吉矢生人教授は「二酸化炭素ガス以外にも、笑気ガスやエーテルなど麻酔効果を持つ気体はいろいろありますが、肺から吸入して脳に作用するメカニズムは、どれもわかっていません」という。
<呼吸や飲み物、また人工呼吸での二酸化炭素の心配は?>
人間は、呼吸で酸素を取り込み、二酸化炭素を放出している。
呼気中に含まれる二酸化炭素は約4%なので、口移しで空気を送り込む人工呼吸では、二酸化炭素中毒を起こす心配はない。
炭酸飲料やビールの泡に含まれる二酸化炭素は、肺でなく胃に入る。
胃酸で気体になり、ゲップとして排出されるので、こちらも中毒の心配はない。
(注)大学入試「化学」の中での知識では
二酸化炭素は常温では気体で、その性質は、
「無色」「無臭」「無毒」「水に少し溶ける」です。
アンモニア合成の発明者ハーバー 「栄光と影」(2)
ベルギー西部のイーペルは、第一次世界大戦中の1915年4月、史上初めて本格的な毒ガス戦の舞台の町となりました。
催涙ガス弾などはそれまでにも使われていましたが、ドイツ軍はイーペルの草原で4月22日、致死性の高い大量殺傷用ガスを初めて用いたのです。
人の粘膜を破壊し、呼吸困難などに陥れて殺害する塩素ガスです。
これをきっかけに、ドイツ軍に限らず英仏など連合国側もたがが外れたように化学兵器を使い始めました。
双方はホスゲンなど新種の兵器を次々に投入。
第一次大戦での毒ガスによる死者は約10万人に上り、市民も含む100万人以上が負傷したといわれています。
戦争と科学の発展は切っても切れないのですが、その陰で戦闘員ではない大量の一般市民が命を落としてきました。
こうした兵器を開発した人は、どんな思いで生涯を過ごしたのでしょうか。
「平時は人類のため、戦時は祖国のため」
この塩素ガスを兵器として開発したのが、「化学兵器の父」と呼ばれるドイツの化学者フリッツ・ハーバー博士(1868~1934)だったのです。
「科学というものは、平時は人類のため。戦時は祖国のため」
それが愛国者だった彼のモットーでした。
開発に成功した時、ドイツ国内ではほとんど反対の声もなく、彼はまさに英雄でした。
彼はドイツのエリート層、特にドイツの皇帝に認められたい一心だったのです。
第一次大戦が終わった年の1918年には、過去に手掛けたアンモニア合成法の業績が認められてノーベル化学賞まで受賞しています。
もっともこの受賞には戦時中の敵国だった英国やフランスから激しい非難の声が上がりました。
ですが、ハーバーの名声はノーベル賞を機にさらに高まっていきました。
今も続く追悼式
イーペルは毒ガス戦だけでなく激しい砲撃戦の舞台ともなりました。
今、この町には当時ドイツと戦った英国側の戦没兵の名前が刻まれた門「メニン・ゲート」があります。
大英帝国戦没者墓地委員会が1927年に建立したもので、54896人の名が残っています。
英国をはじめとした連合軍兵士は、この門を起点に戦場へ向かいました。
門にはオーストラリアやインド、カナダなどからの出征兵士の名前も多く刻まれています。
祖先の追悼のため、今も世界中から多くの人々が訪れる場所なのです。
イーペルでは毎晩、戦没者の追悼演奏が行われています。
式典を主催する民間団体「ラストポスト協会」はトランペット演奏をする楽団を含め、20人以上のスタッフ全員がボランティア。
各自、仕事が終わってから門に駆け付け、15分ほどの式典を行います。
この団体幹部のベノワ・モトリーさんによると、
「1928年以降、ナチス・ドイツによる占領時代を除いて毎日続けています。追悼の思いを一日たりとも忘れないためです」
2020年には新型コロナウイルスの影響でこのイベントの続行が危ぶまれました。
ですが欧州メディアによると、今も見物客の人数を制限し、互いの距離を取りながら、追悼演奏は続けられているということです。
「英雄」を待ち受けていた運命
さて、ドイツの英雄となったハーバーはその後どうなったのか。
1933年にヒトラー率いるナチスが政権を握ると、彼の人生は暗転していく。
彼はユダヤ人だったのだ。
ナチスのユダヤ人迫害政策の影響で、徐々にハーバーは「追われる身」となる。
ドイツを愛し、ユダヤ教からキリスト教に改宗までしたハーバー。
だが彼は結局そのドイツから裏切られ、1933年に研究機関を去ることになる。
フランスに住んでいた息子を頼り、まずハーバーはパリに逃げた。
さらに英国などを転々とした後、1934年1月にスイス・バーゼルで病死した。
ライン川が流れるこの町の目と鼻の先には、彼が愛し抜いた祖国ドイツがあった。
世界はその後も化学兵器を使い続けた。
第二次大戦、ベトナム戦争、イラクのクルド人が虐殺されたハラブジャ事件、化学テロである地下鉄サリン事件、そしてシリア内戦。
第一次大戦から100年以上たった今も、それは現在進行形で人類の脅威であり続けている。
シリアではアサド政権による猛毒神経ガス・サリンなどを使った化学兵器攻撃が何度も疑われている。
だが政権側はその度に使用を否定し、国際調査も進まない。
ハーバーは毒ガスの使用について、同僚にこう説明していたという。
「むしろ使用によって戦争を早く終結させ、多くの人の命を救える」
この論理は、のちに第二次大戦で広島、長崎への原爆投下を正当化した米国側の主張にそっくりだ。
しかし大量破壊兵器の使用はこうして21世紀の今も続き、多くの人が命を失い続けているのが現実でもある。
祖国ドイツのため、化学兵器開発を誇りに思っていたハーバー。
だが彼は死の直前、息子にこんな遺言を残している。
「クララと一緒の墓に埋めてほしい」
毒ガスを開発した男が人生の最後に思い出したのは、その毒ガスの使用に抵抗した最初の妻クララだったのだ。
二人は今、スイス・バーゼルの同じ墓に眠っている。
アンモニア合成の発明者ハーバー 「栄光と影」(1)
今日、ドイツの化学者フリッツ・ハーバーについての記事が目に留まりました。
高校の化学の教科書に必ず登場するハーバーですが、自分の知らなかった一面を初めて知り、大きなショックを受けました。
ノーベル賞も受賞した彼の栄光と影について記しておこうと思います。
化学の教科書の、「化学平衡」「非金属元素窒素」の項に必ず登場するのが、アンモニアの工業的製法「ハーバー・ボッシュ法」です。
このアンモニアの合成法は、ドイツのフリッツ・ハーバーが発明し、カール・ボッシュが触媒を改良して工業化に成功させました。(1906年)
当時、このアンモニア合成法は、「水と石炭と空気からパンを作る方法」とも言われた大発明でした。
このように言われた理由ですが、パンの原料である小麦を始めとして農作物を育てるには窒素分を含む肥料の十分な供給が不可欠です。
その窒素を供給する化学肥料を生成するのにハーバー・ボッシュ法が使えるため、この方法の発見によって農作物の収穫量は飛躍的に増加したのです。
化学肥料の誕生以前は、農作物の量が人口増加に追いつかず、人類は常に貧困と飢餓に悩まされていました。
しかしハーバー・ボッシュ法による窒素の化学肥料の誕生や過リン酸石灰によるリンの化学肥料の誕生により、ヨーロッパやアメリカ大陸では、人口爆発にも耐えうる生産量を確保することが可能となったのです。
ハーバーは本法の業績により、1918年にノーベル化学賞を受賞、またボッシュは本法を応用した高圧化学反応の研究により、1931年にノーベル化学賞を受賞しています。
この方法は同時に、平時には肥料を、戦時には火薬を空気から作るとも形容され、爆薬の原料となる硝酸の大量生産を可能にしたことから、その後の戦争が長引く要因をも作りました。
その例ですが、ドイツ帝国は、第一次世界大戦で使用した火薬の原料の窒素化合物の全てを国内でハーバー・ボッシュ法を元にして調達できたのです。
一方、本法によるアンモニア合成法の開発以降、生物体としてのヒトのバイオマスを、従来よりもはるかに多い量で保障するだけの窒素化合物が、世界中の農地生態系に供給され、世界の人口は急速に増加しました。
現在では地球の生態系において最大の窒素固定源となっています。
さらに、農地生態系から直接間接双方の様々な形で、他の生態系に窒素化合物が大量に流出しており、地球全体の生態系への窒素化合物の過剰供給をも引き起こしています。
この現象は、地球規模の環境破壊の一端を成しているのではないかとする懸念も生じていますが、これについてはまだ良く分かっていません。
このウェブサイトは、
NetCommons3.3.7で動いています。
NetCommons プロジェクト 開発の、
CMS+グループウェアです!
| 日 | 月 | 火 | 水 | 木 | 金 | 土 |
27 1 | 28 1 | 29 | 30 | 31 | 1 | 2 |
3 | 4 | 5 | 6 | 7 | 8 | 9 |
10 | 11 | 12 | 13 | 14 | 15 | 16 |
17 | 18 | 19 | 20 | 21 | 22 | 23 |
24 | 25 | 26 | 27 | 28 | 29 | 30 |