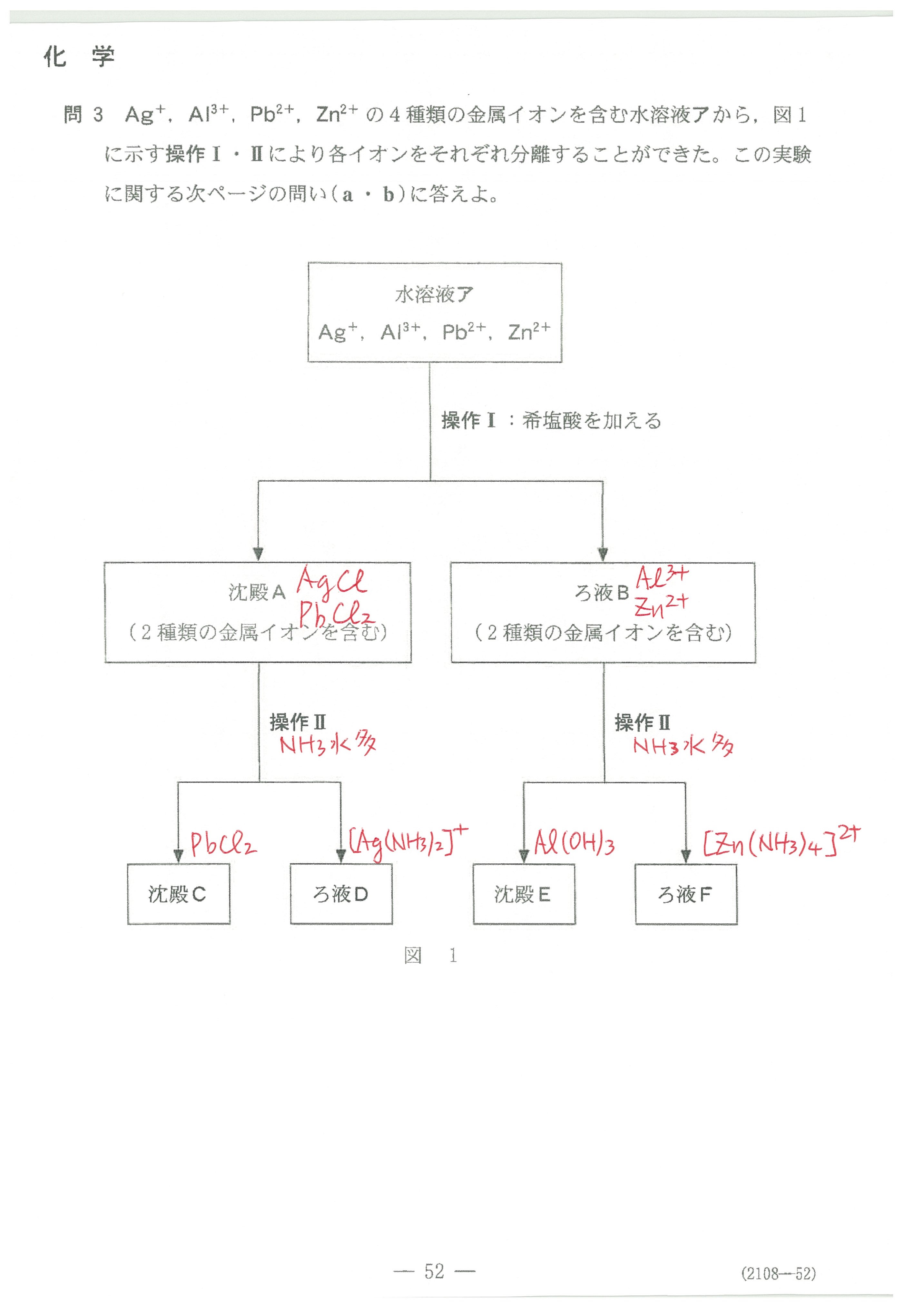
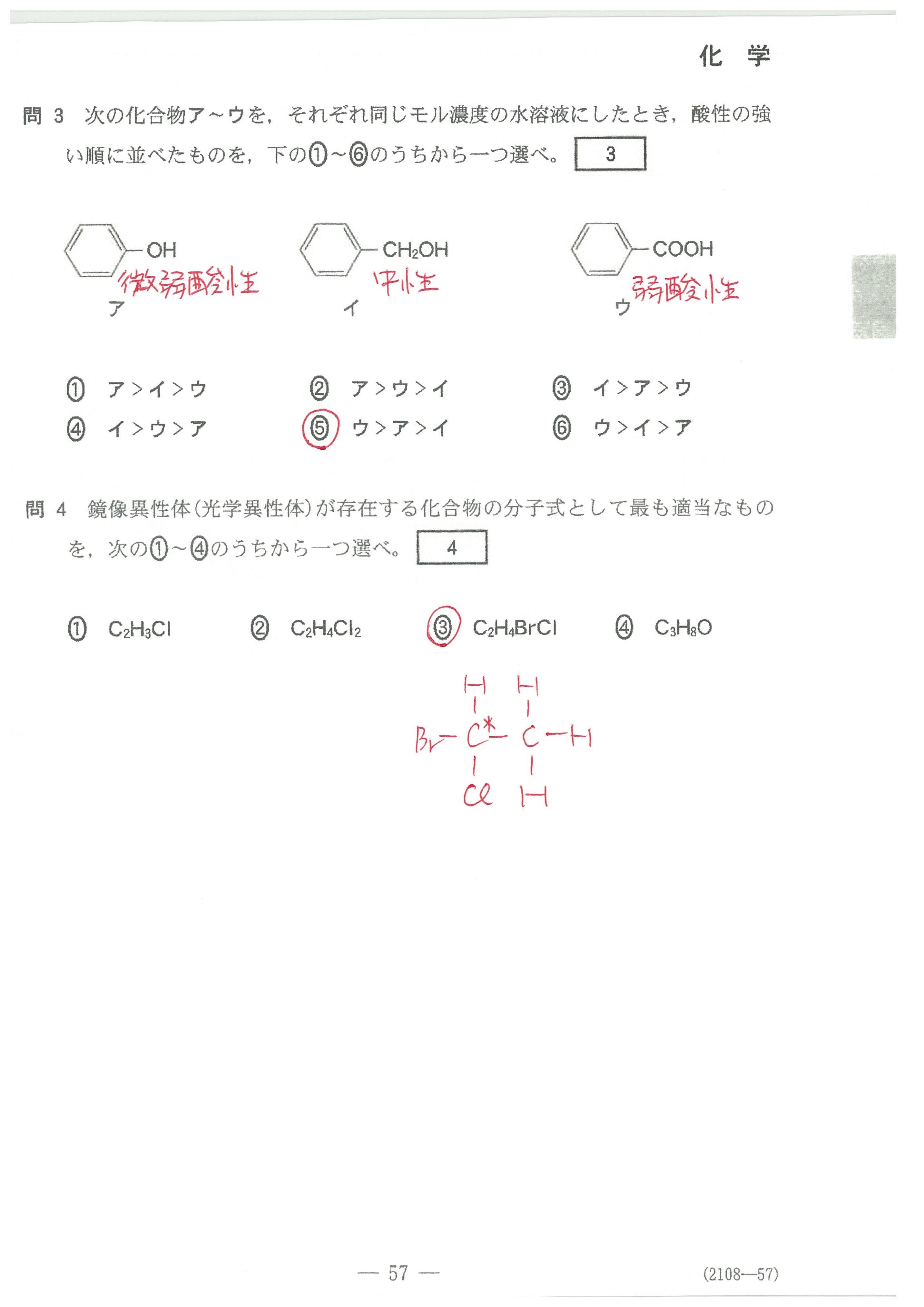
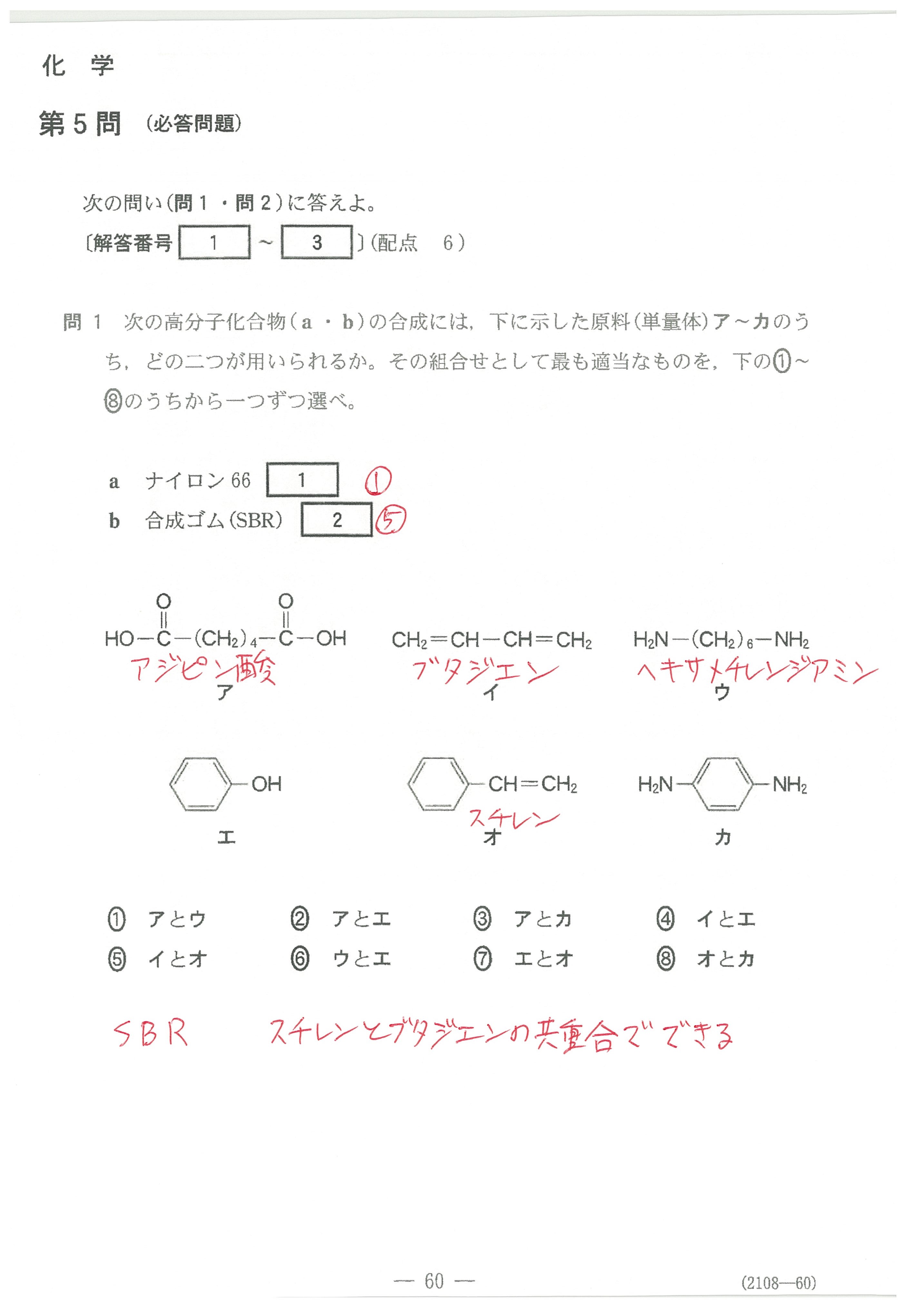
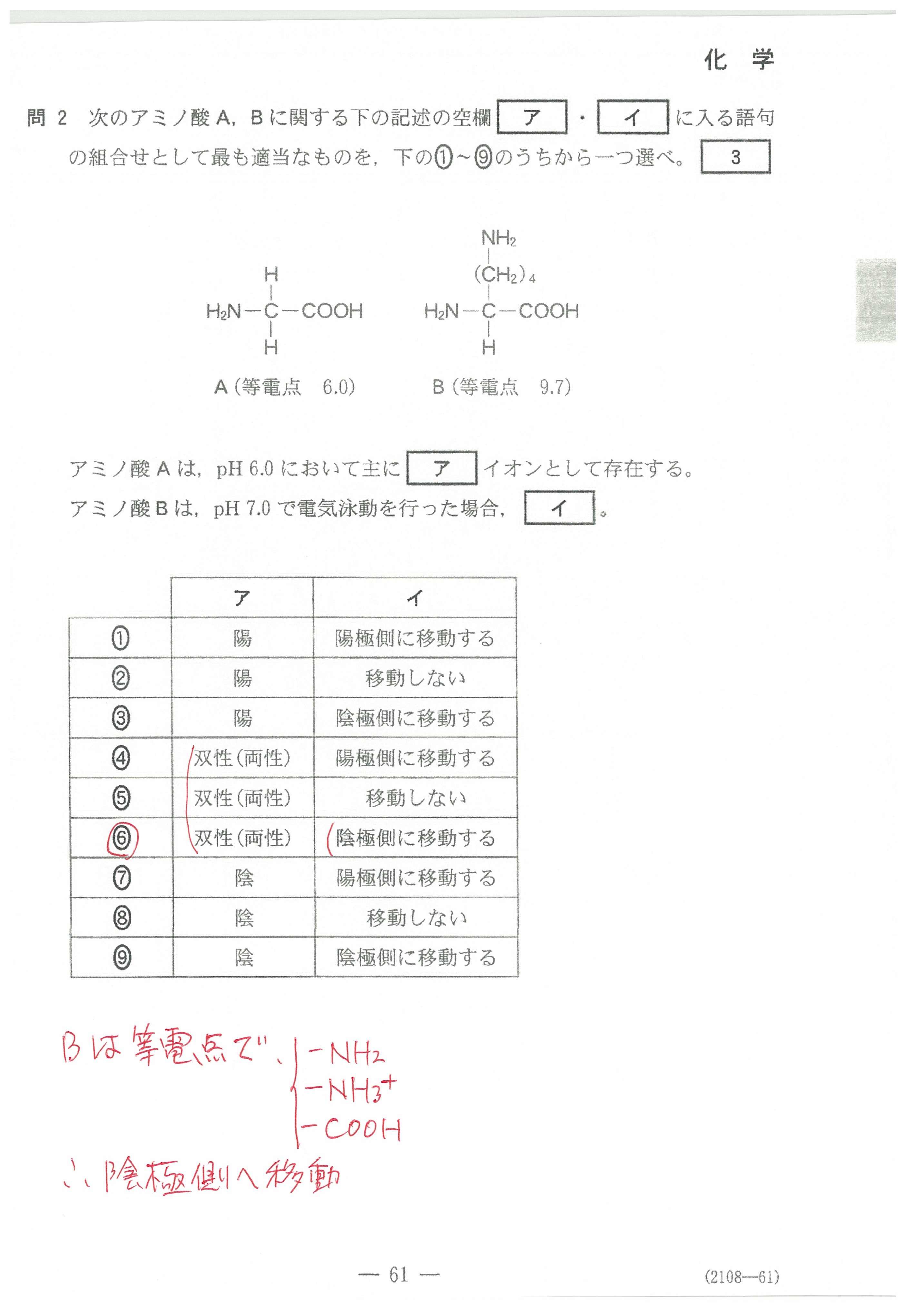
入試問題・模試問題 解説等
共通テスト試行問題「化学基礎」H30年公表_解答解説
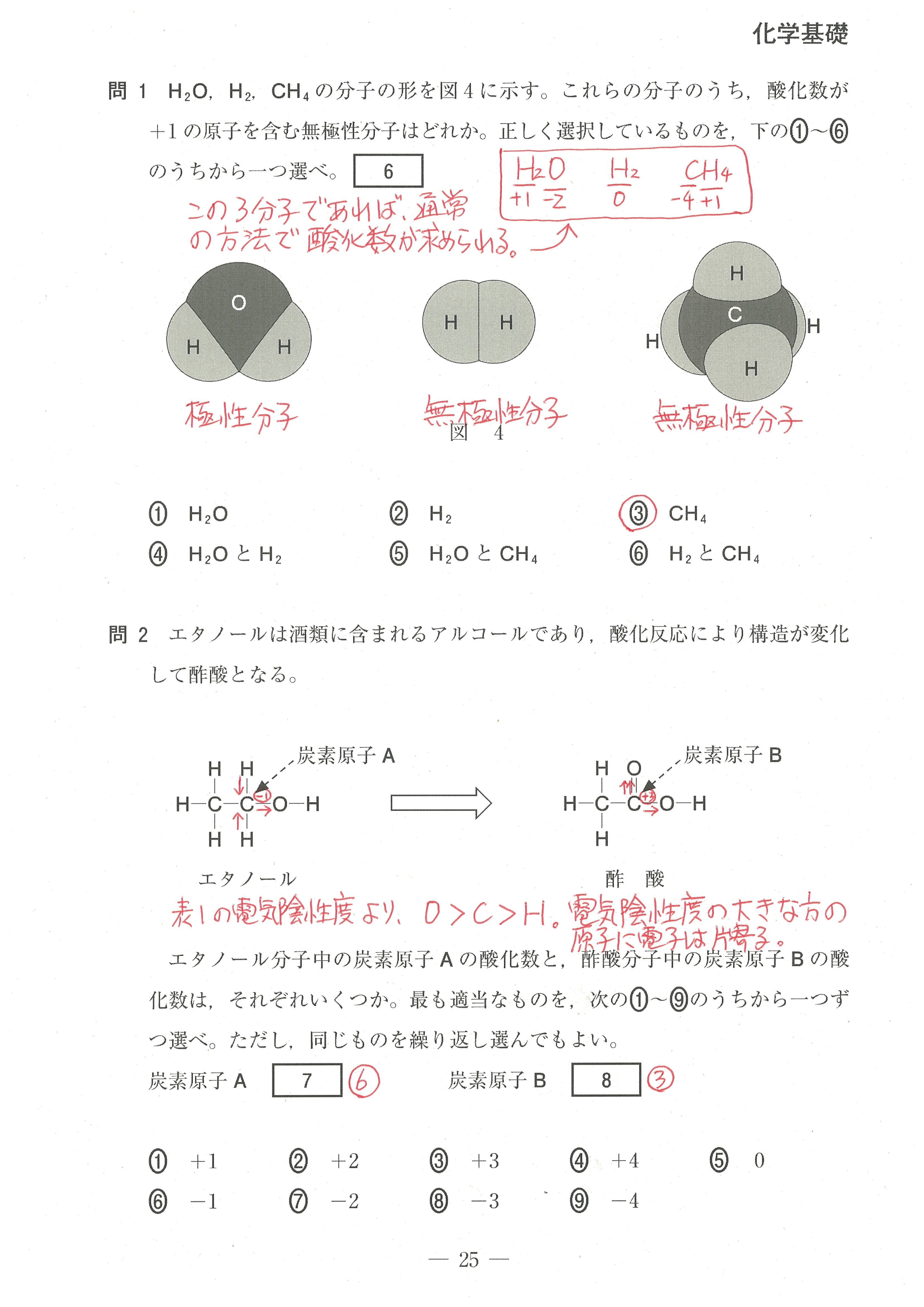
第1問(問1)
この問題では、解答するのに必要な情報は、赤下線の部分だけです。
文章のどの部分が解答に必要な情報なのかを探すトレーニングが、新たに必要になると思います。
このように情報が多く書かれている場合は、まず設問を読んでから、記述文を読んでいくようにすると良い。
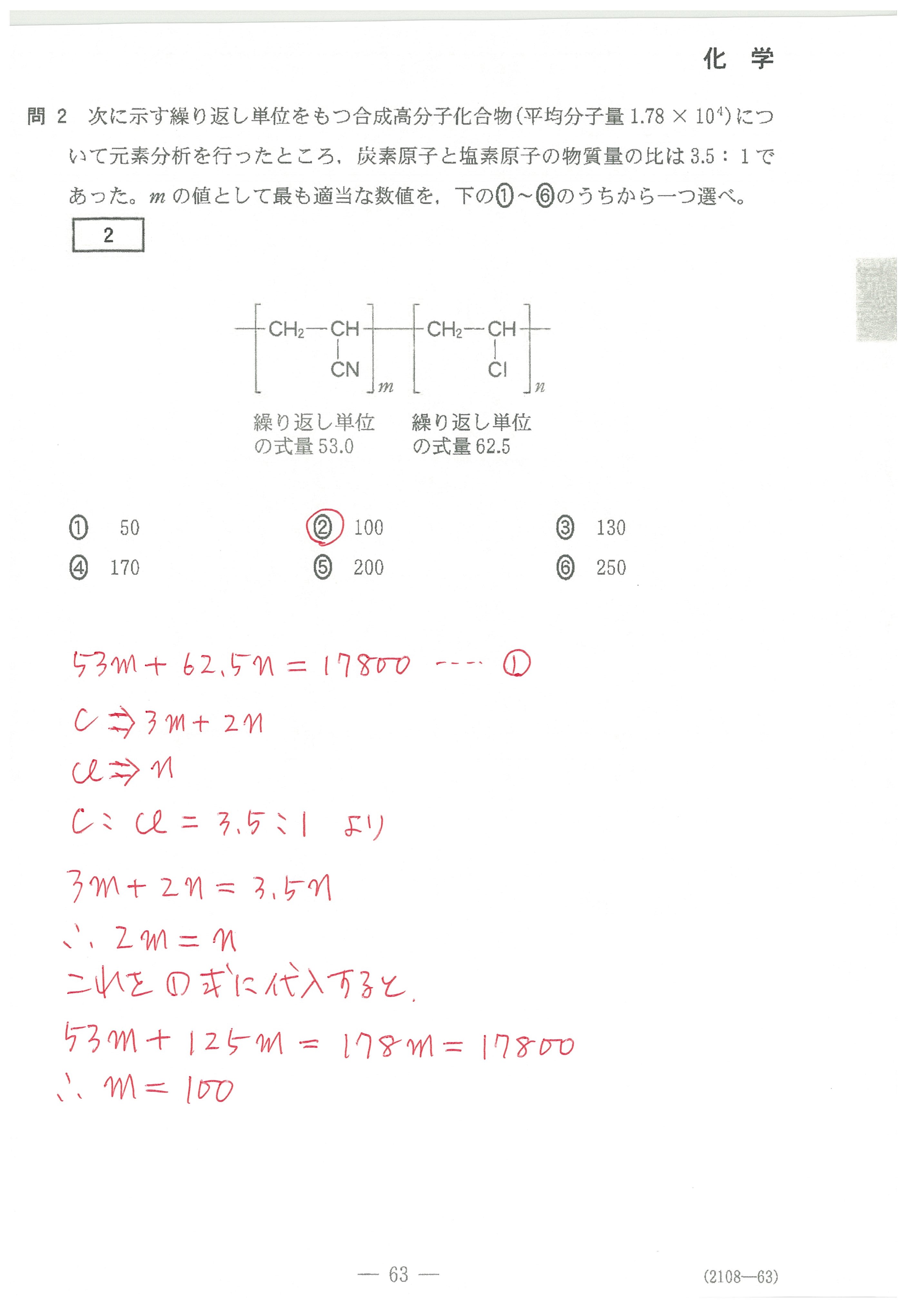
第1問(問2)
①については、食塩水の沸点は純水の沸点より高いという記述が教科書にあるが、凍る温度(凝固点)は、これから推測するしかない?
ただ、食塩水が凍る温度は純水の凍る温度より低いということは、中学校以前に教わっているのでは?
第1問(問3)
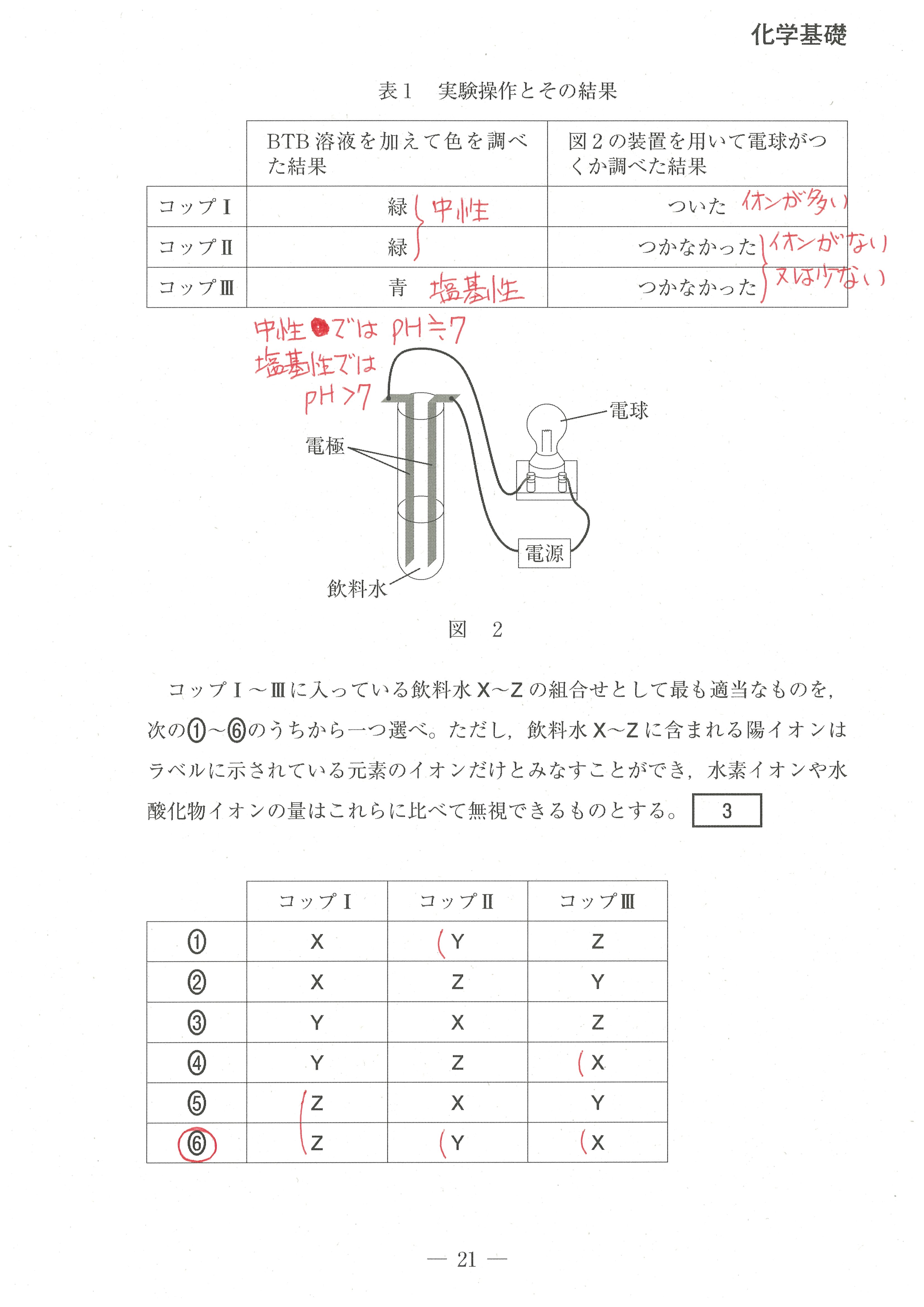
水中のイオンの量が多いと電気を導きやすくなるが、溶液X、Y、Z中のイオンの量をざっと比較して判定する。
この、「ざっと比較すること」に慣れていって欲しいと思います。
第1問(問4)
センター試験同様の設問。
教科書の基本的内容についての問い。
第1問(問5)

教科書の基本的内容についての問い。
ただし、出題分野は、序章の「化学と人間生活」から。
これまでのセンター試験でも、この分野からの出題はあったので、この分野もしっかりと習得しておきましょう。
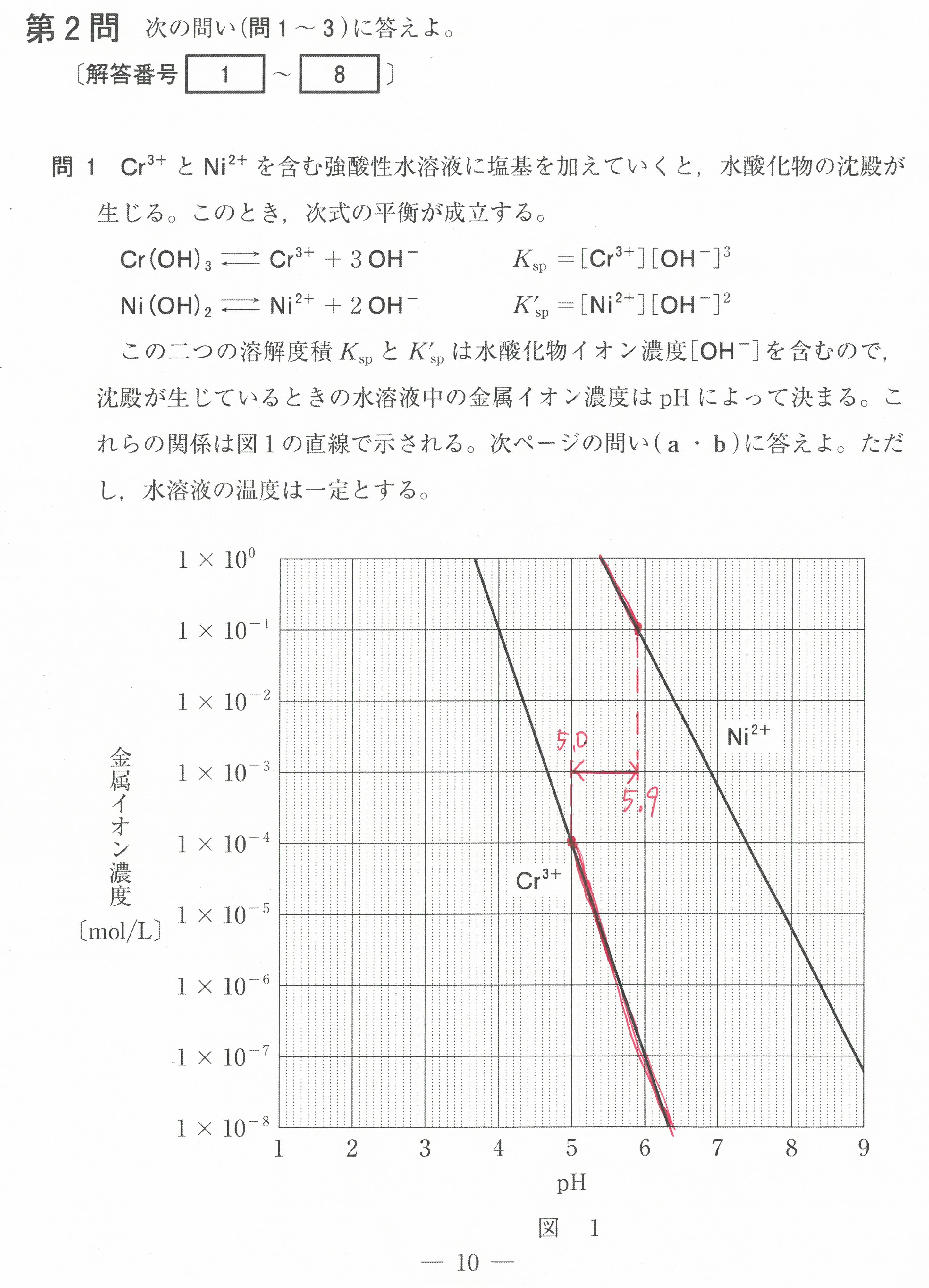
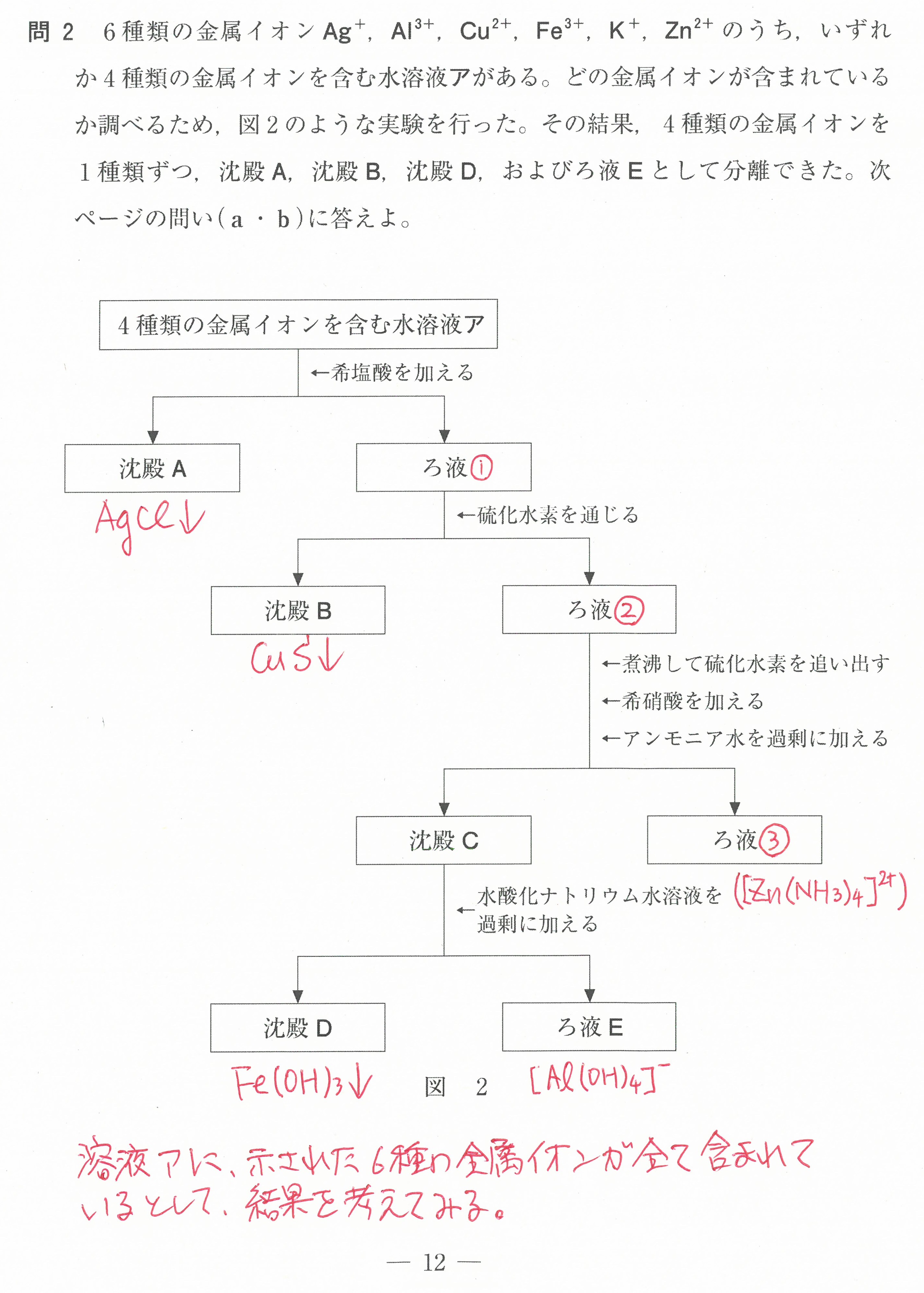
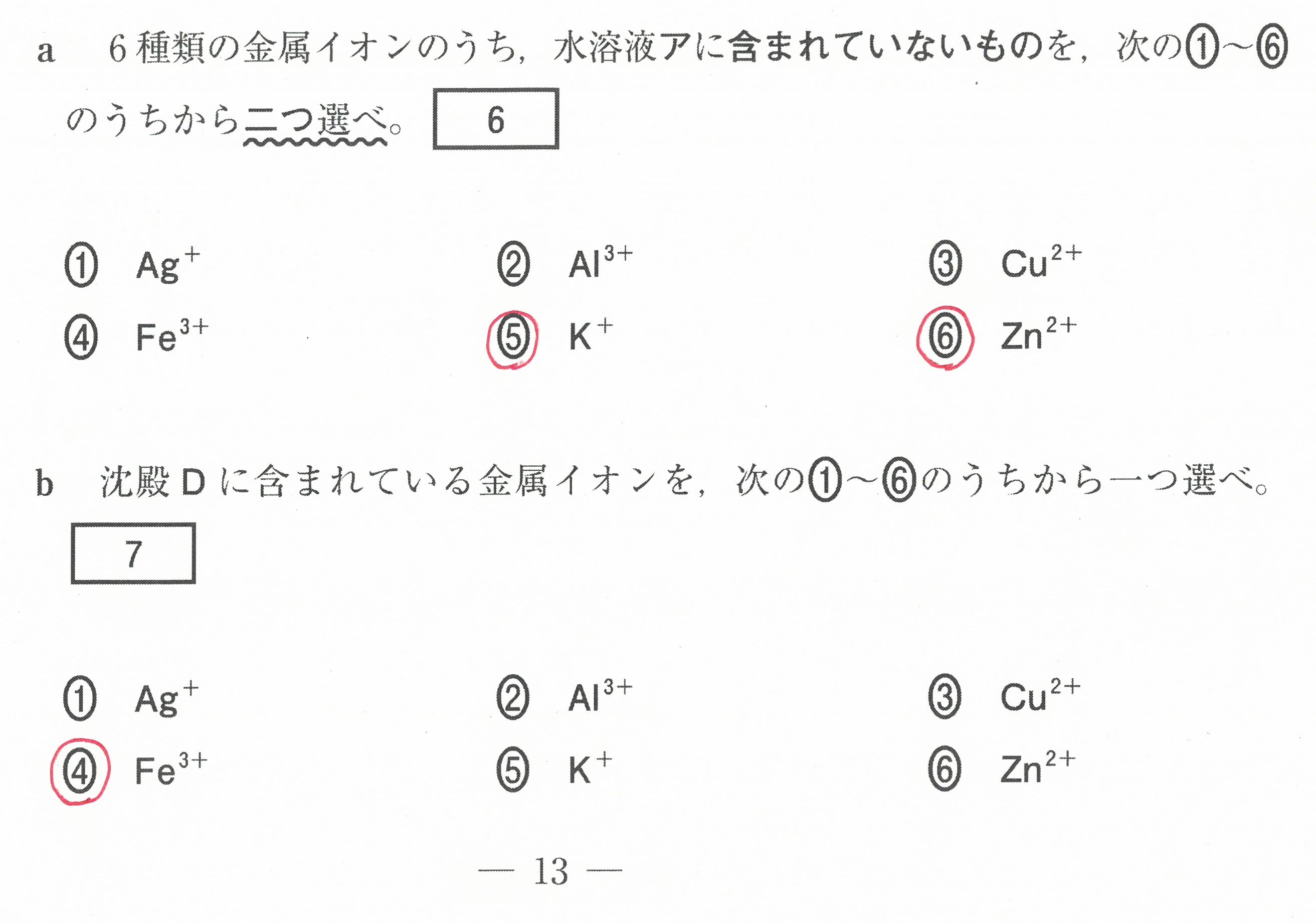
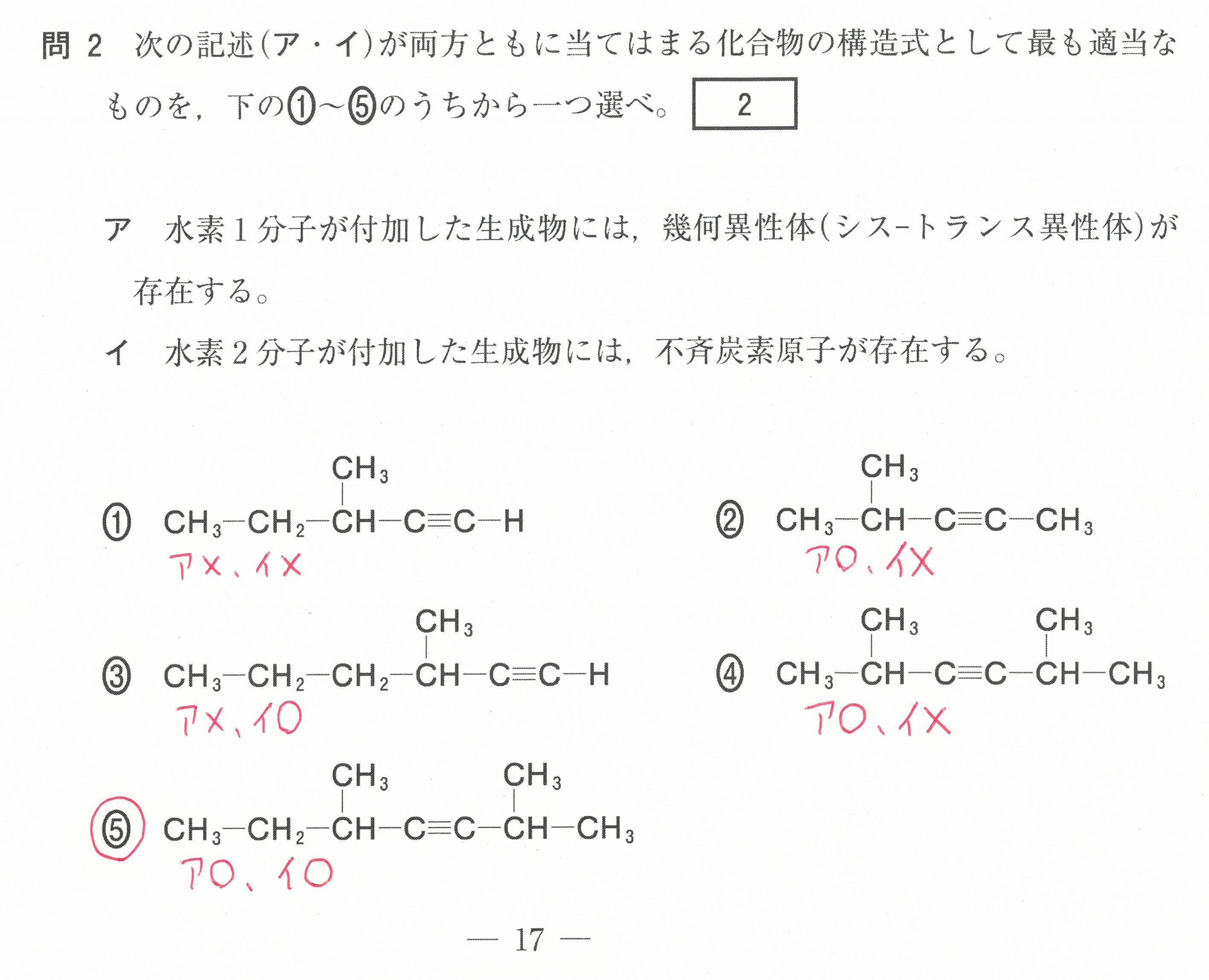
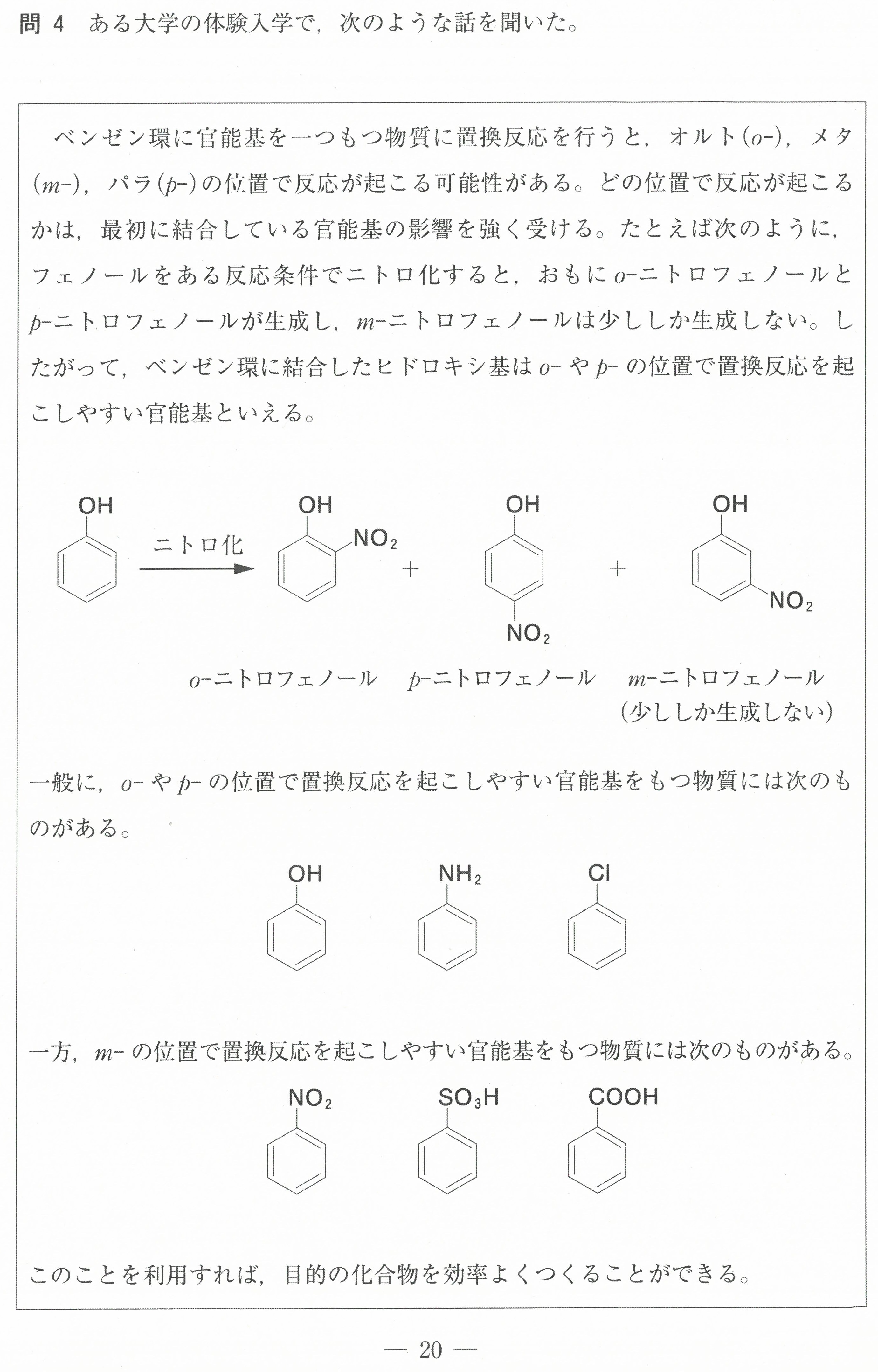
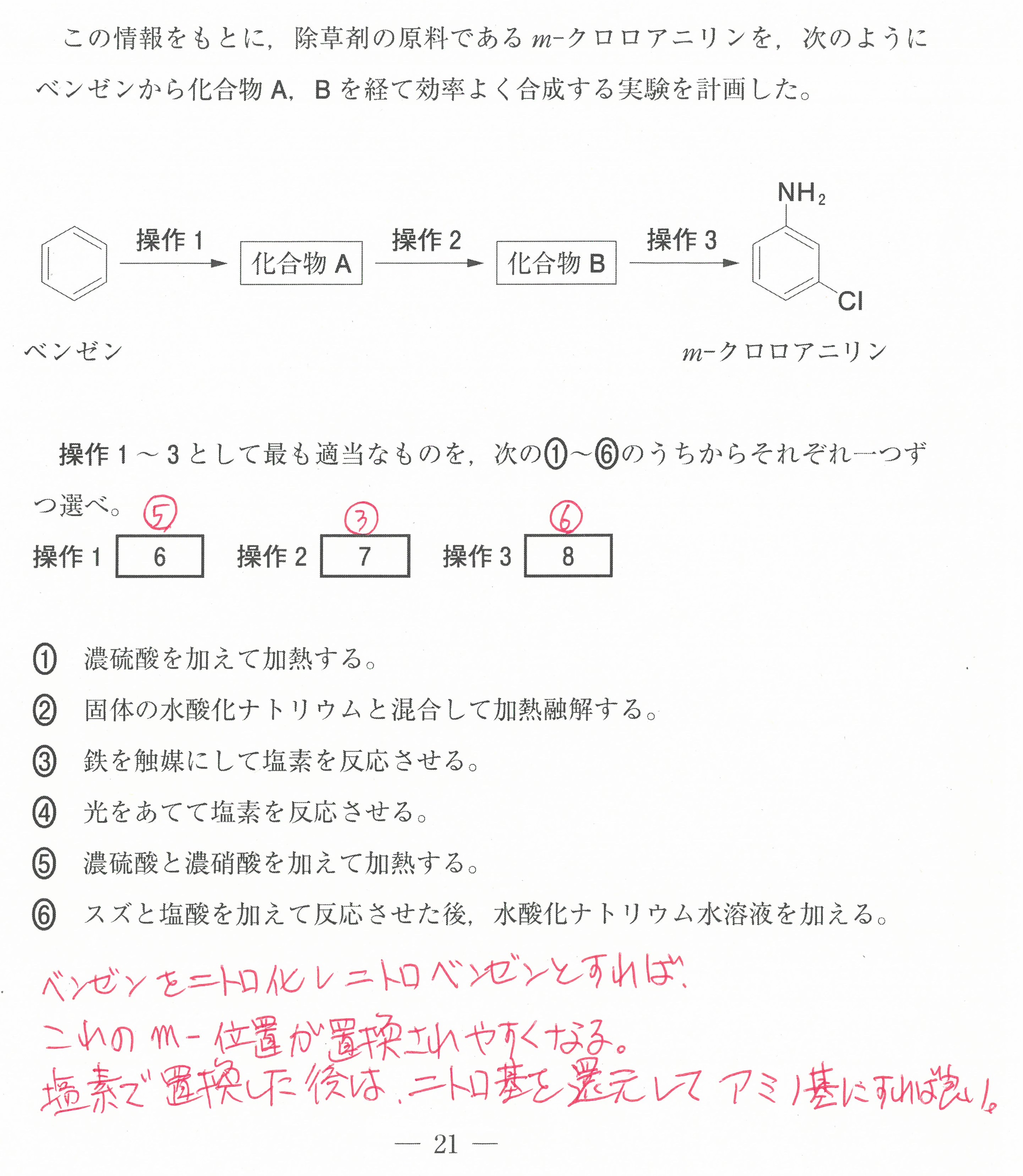
第2問(問1)(問2)
この設問は、難しく感じるかもしれないが、「電気陰性度の大きな原子が電子を強く引きつけ、電気陰性度の値が大きいものほど電子を強く引きつける」ということから考えていけば良い。
電気陰性度の大きな原子が、単結合1つあたり1コの電子を引き寄せる(-1になる)。
二重結合1つあたりでは2コの電子を引き寄せる(-2になる)ということです。
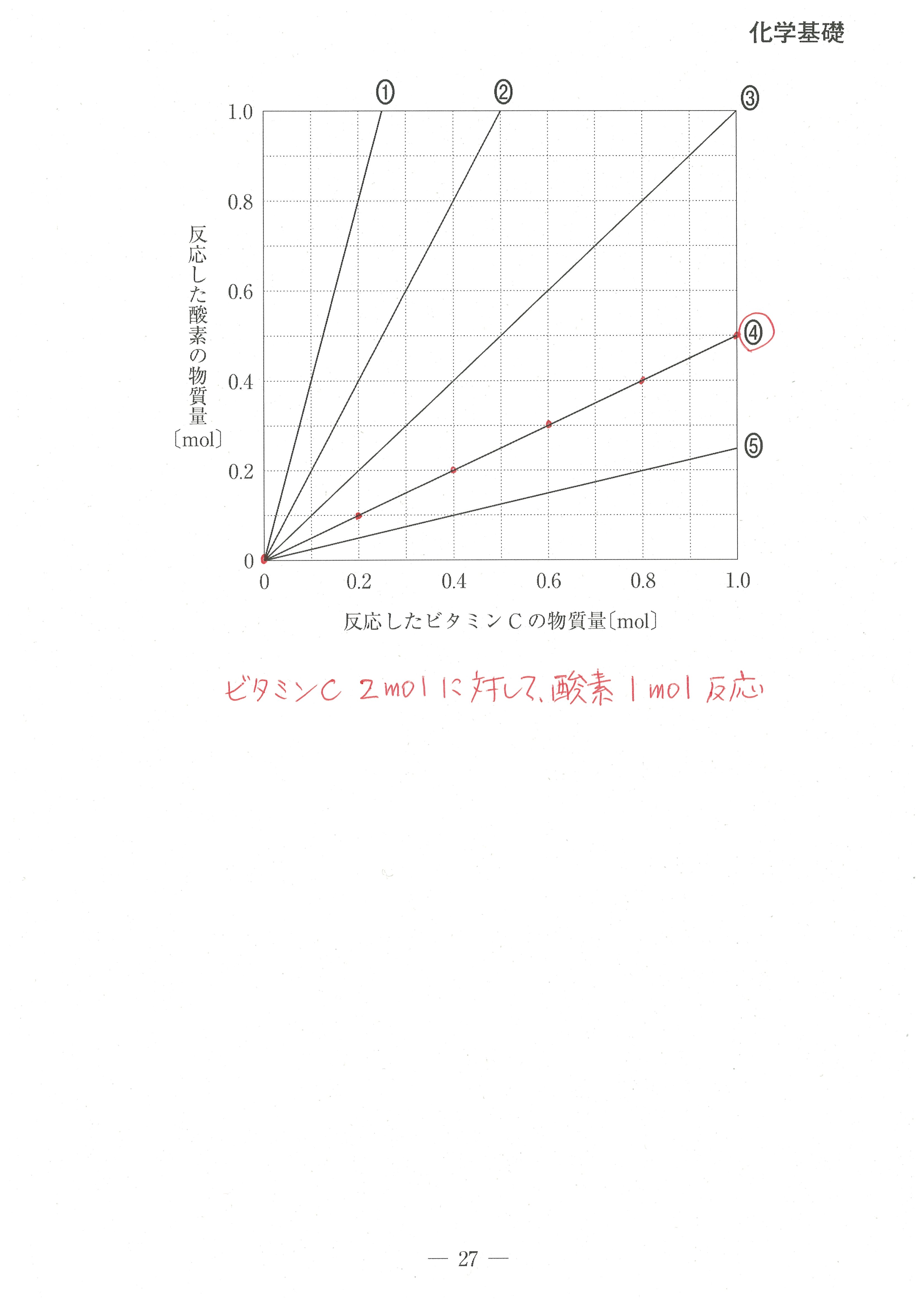
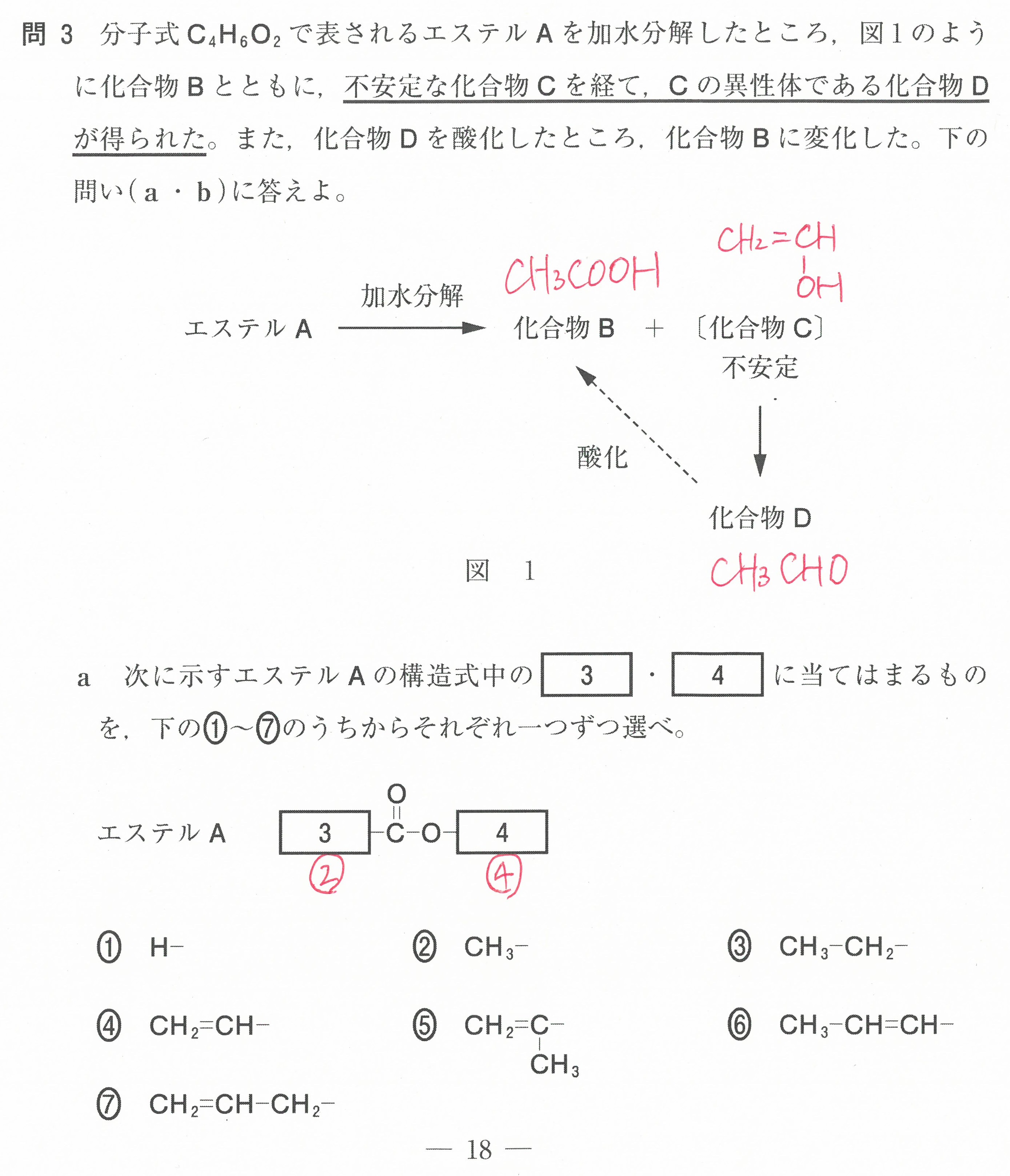
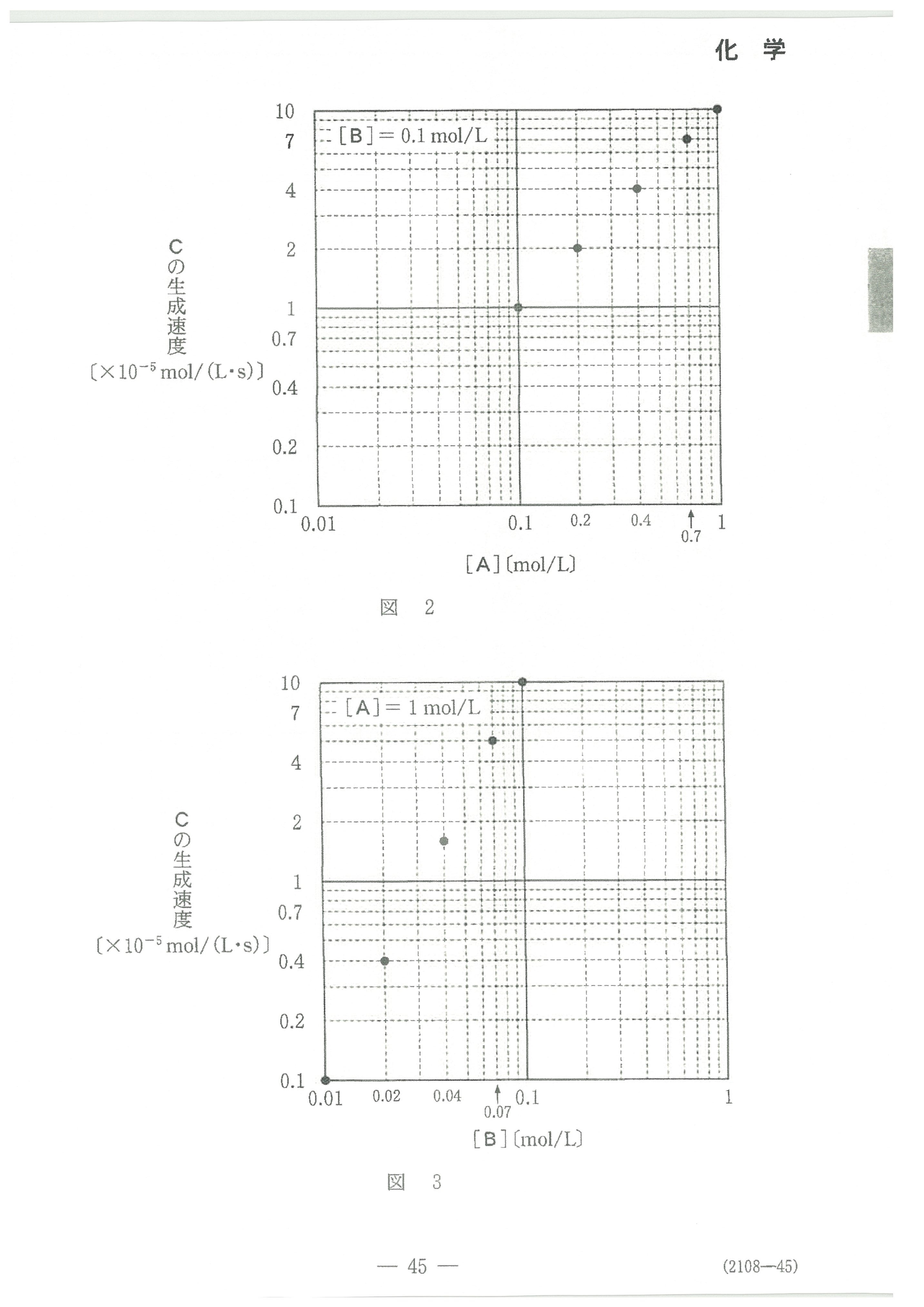
第2問(問3)
見慣れないビタミンCが出てきても、とまどわずに、解説のように式を書けば、反応するビタミンCと酸素の量関係が分かります。
あとは、グラフをキチンと読めればOK。
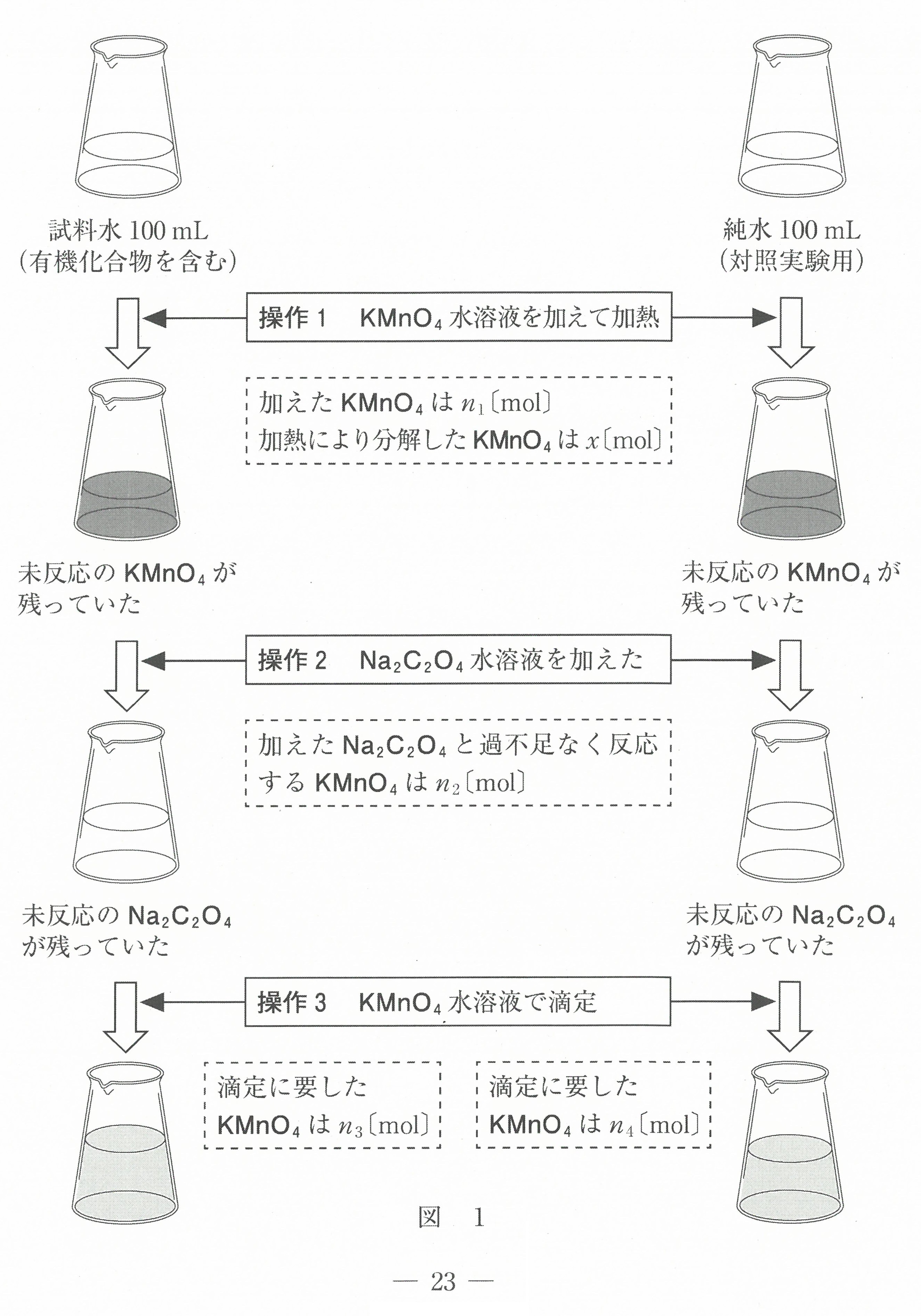
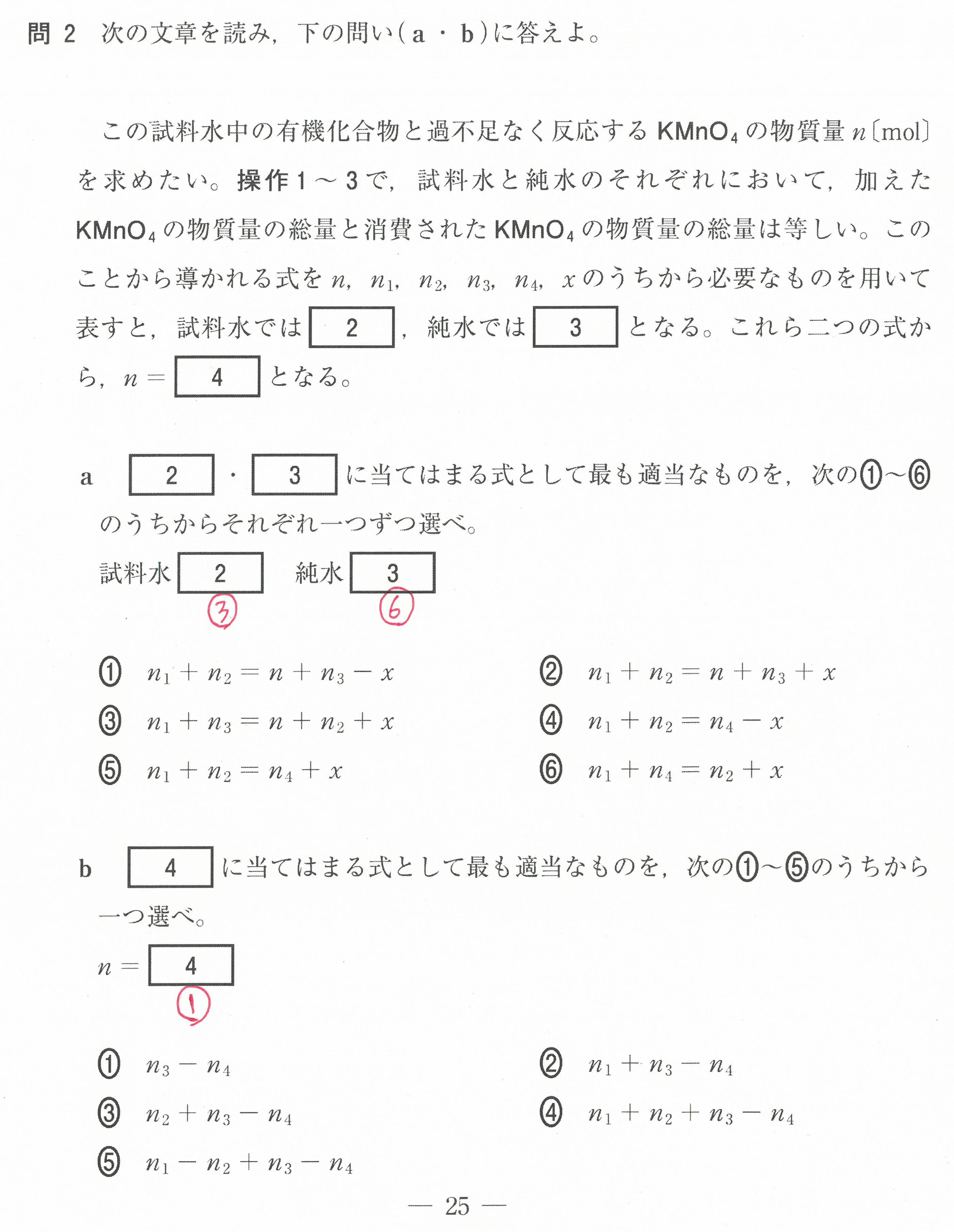
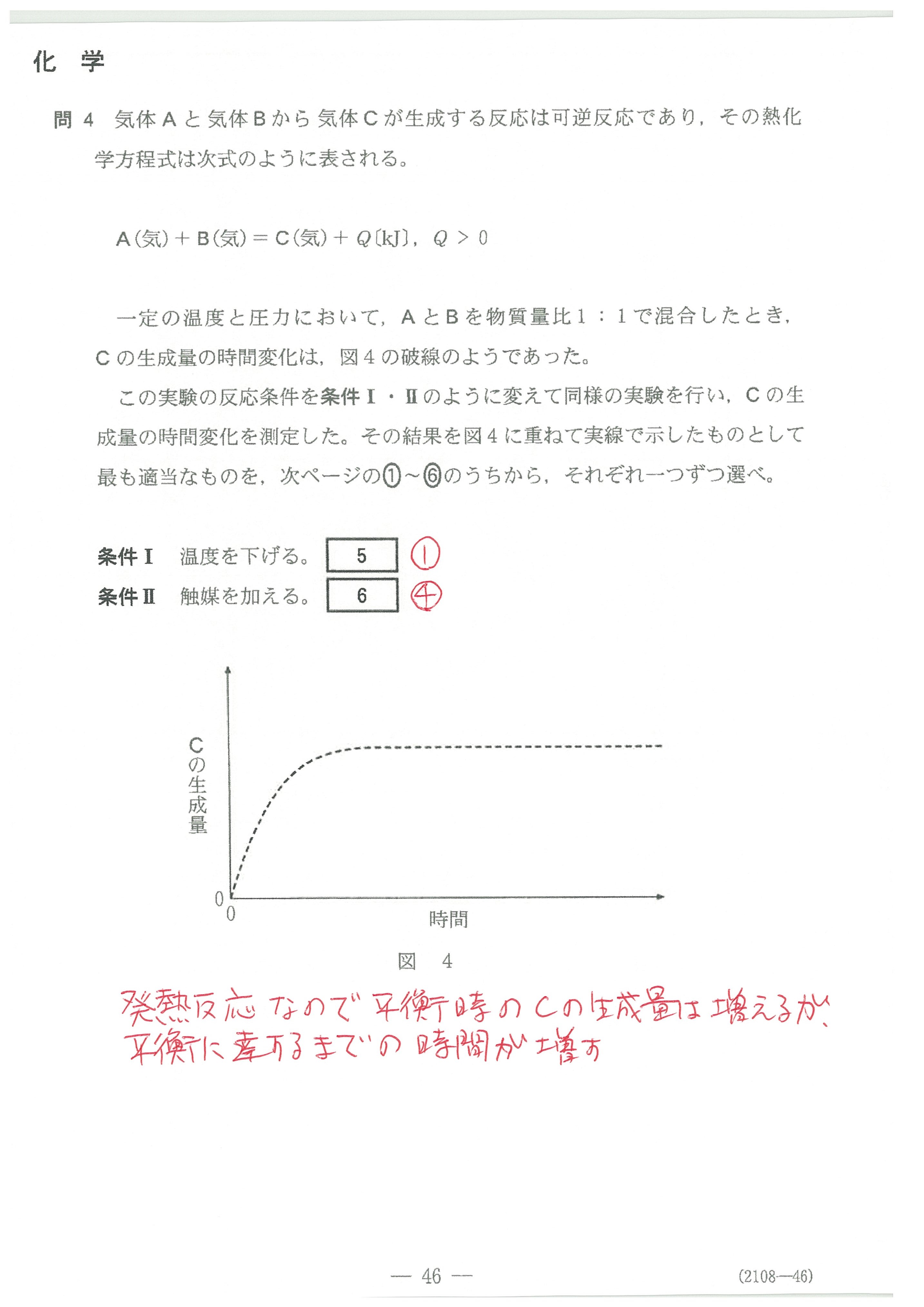
第3問(問1)(問2)(問3)

(問1)では、いつもの出題のように、試料溶液のモル濃度を中和滴定の公式で求めるのではなく、「実験に際して原液を何倍に薄めれば良いか?」という設問になっている。
これが目新しく、とまどうのではないか?
(問2)では、①~③はコニカルビーカー中のHClの濃度ではなく、HClの物質量を考えると分かりやすい。
④では、ビュレット先端の中の空気が押し出された時、ビュレットの液面が下がるので、読み取る滴下量が空気の分増えたことになってしまう。
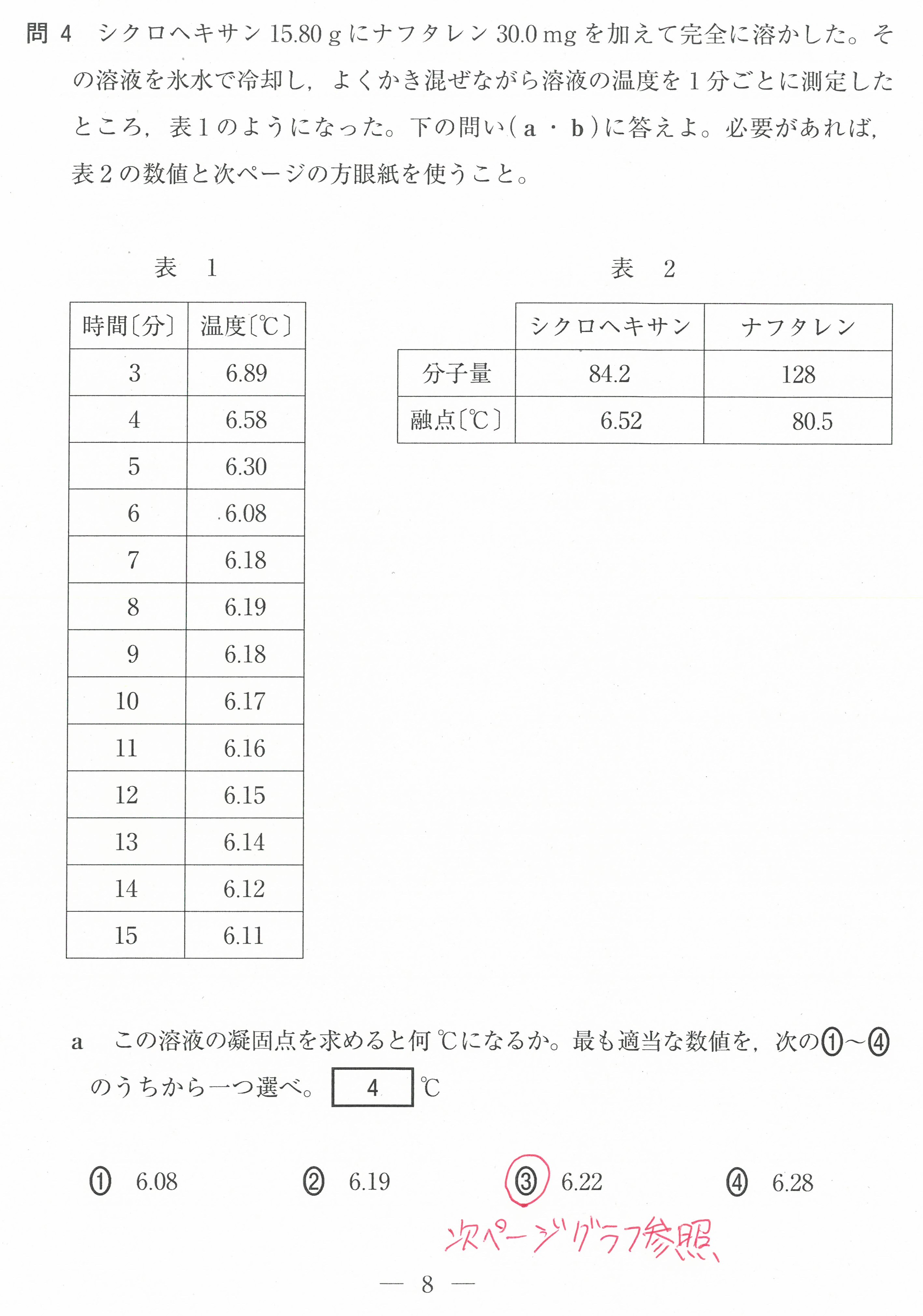
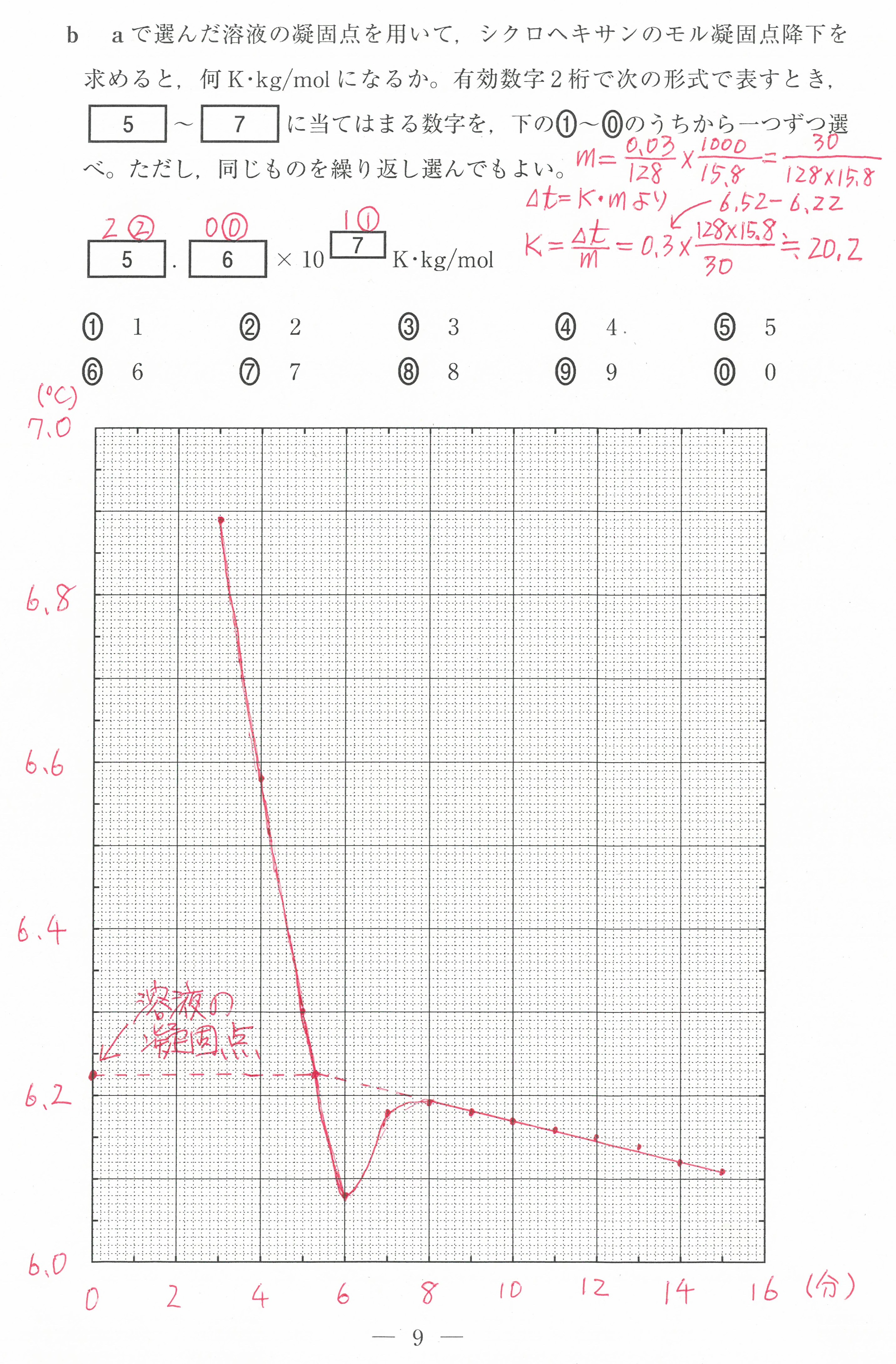
第3問(問4)
(1)(2)の反応そのものは、化学基礎では学習していないが、問題文中で解説されているので、それに従って考えていけば大丈夫。
共通テスト試行問題「化学」H29年公表_解答解説
2020 センター「化学」本試 とまどう問題は?
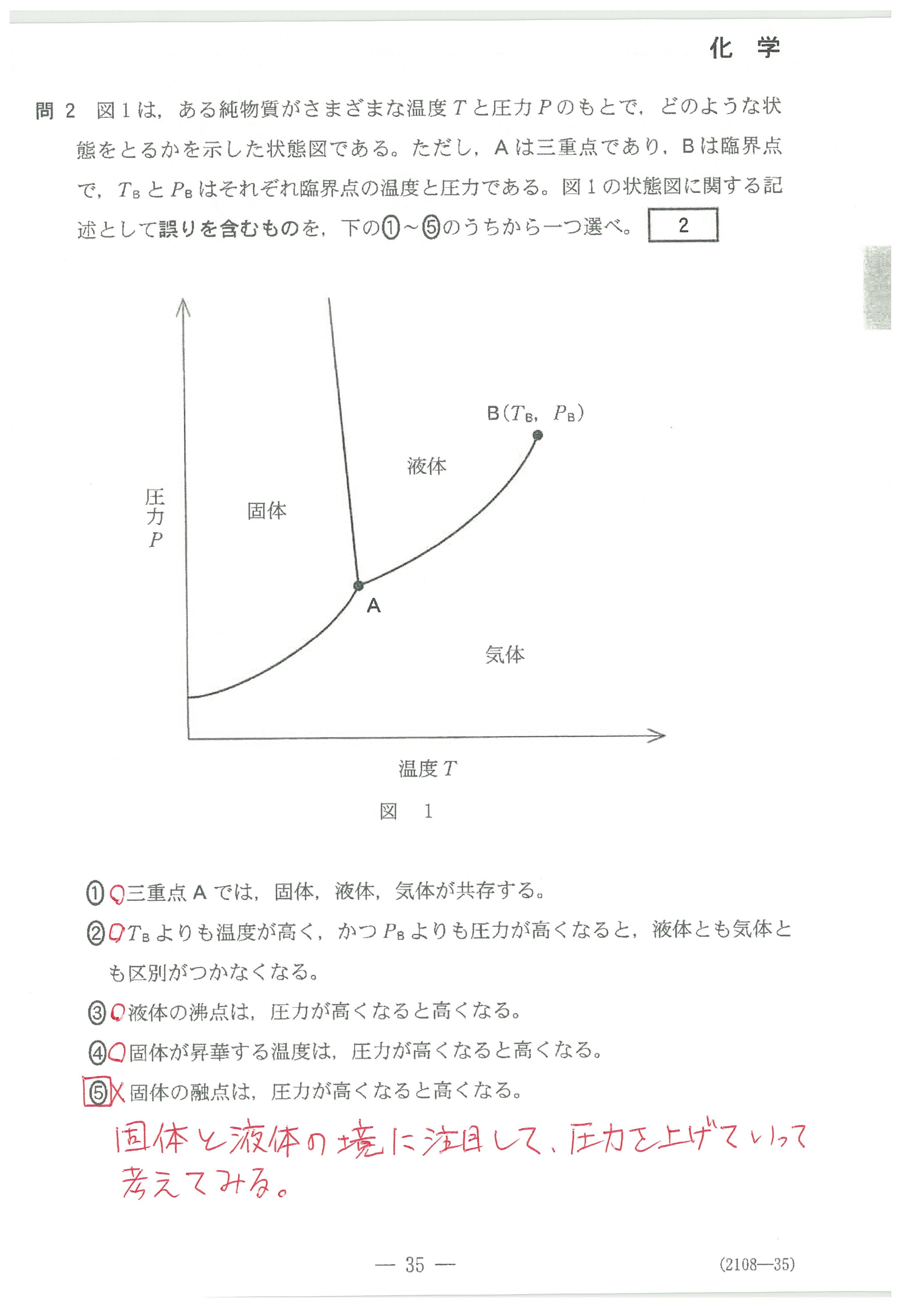
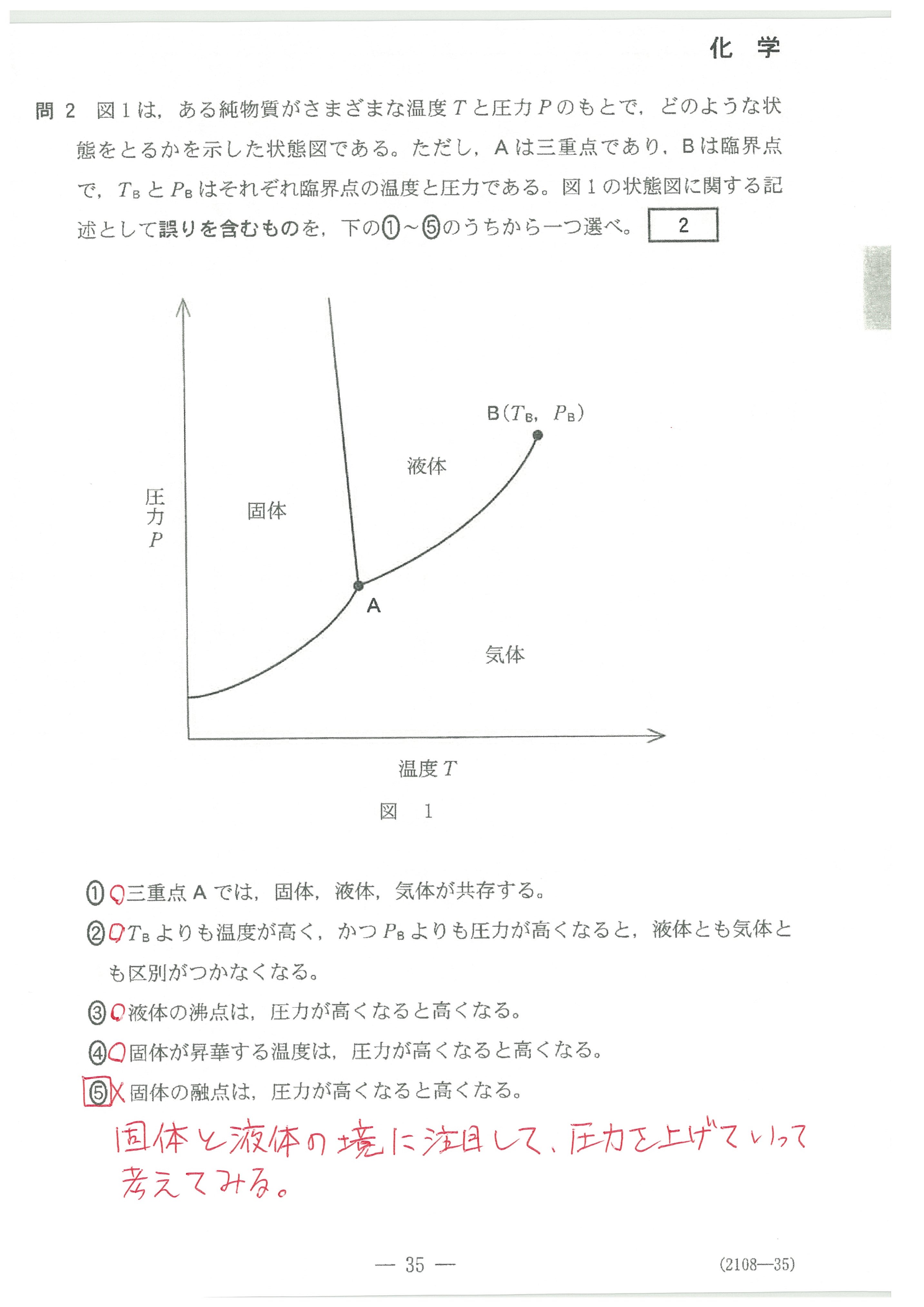
・第1問(問2)状態図について、細かい記述
②は、臨界点についての説明ですが、教科書には載っていないのでは?
ただ、この問題では、⑤の誤りはすぐに見つけられると思います。
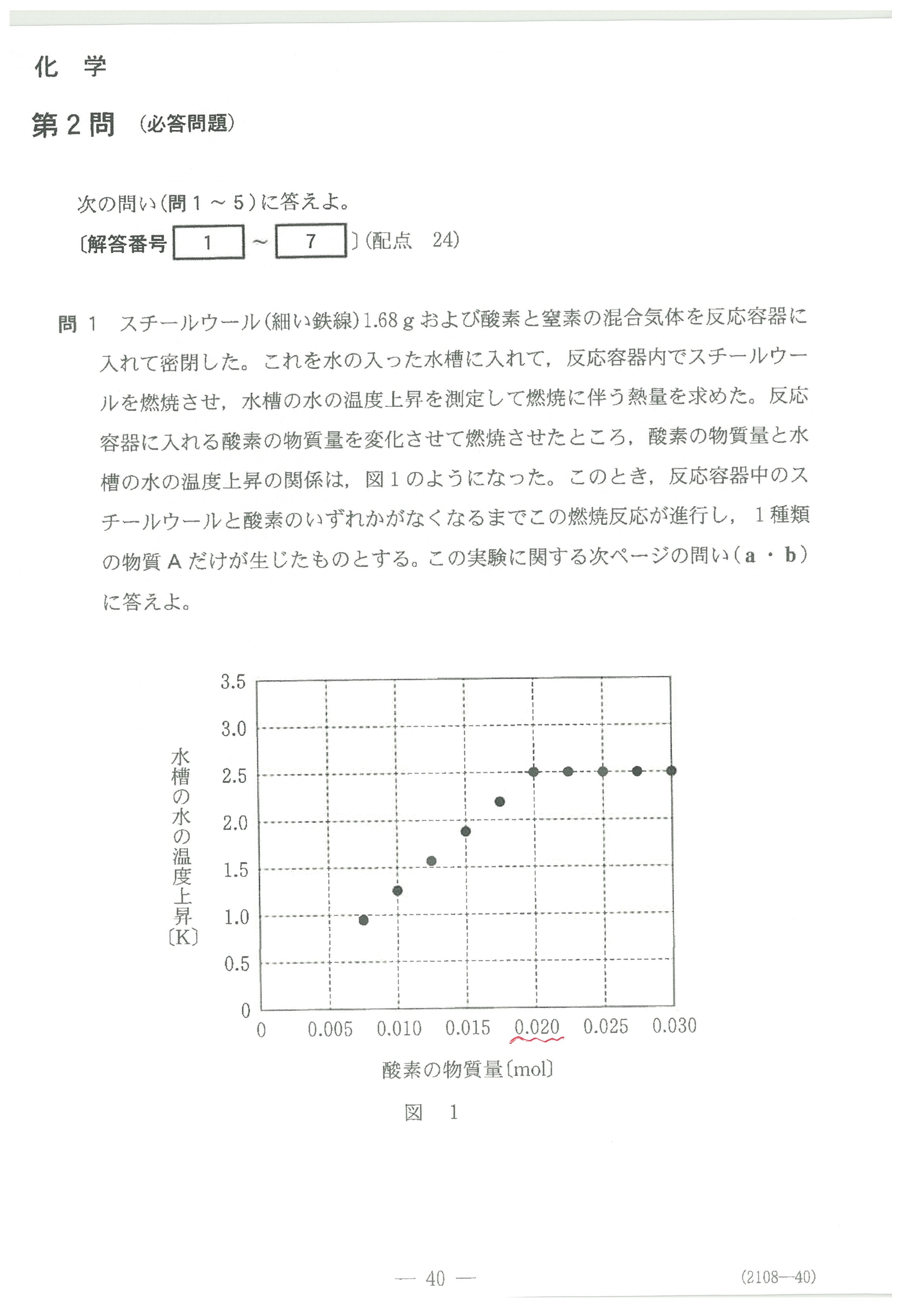
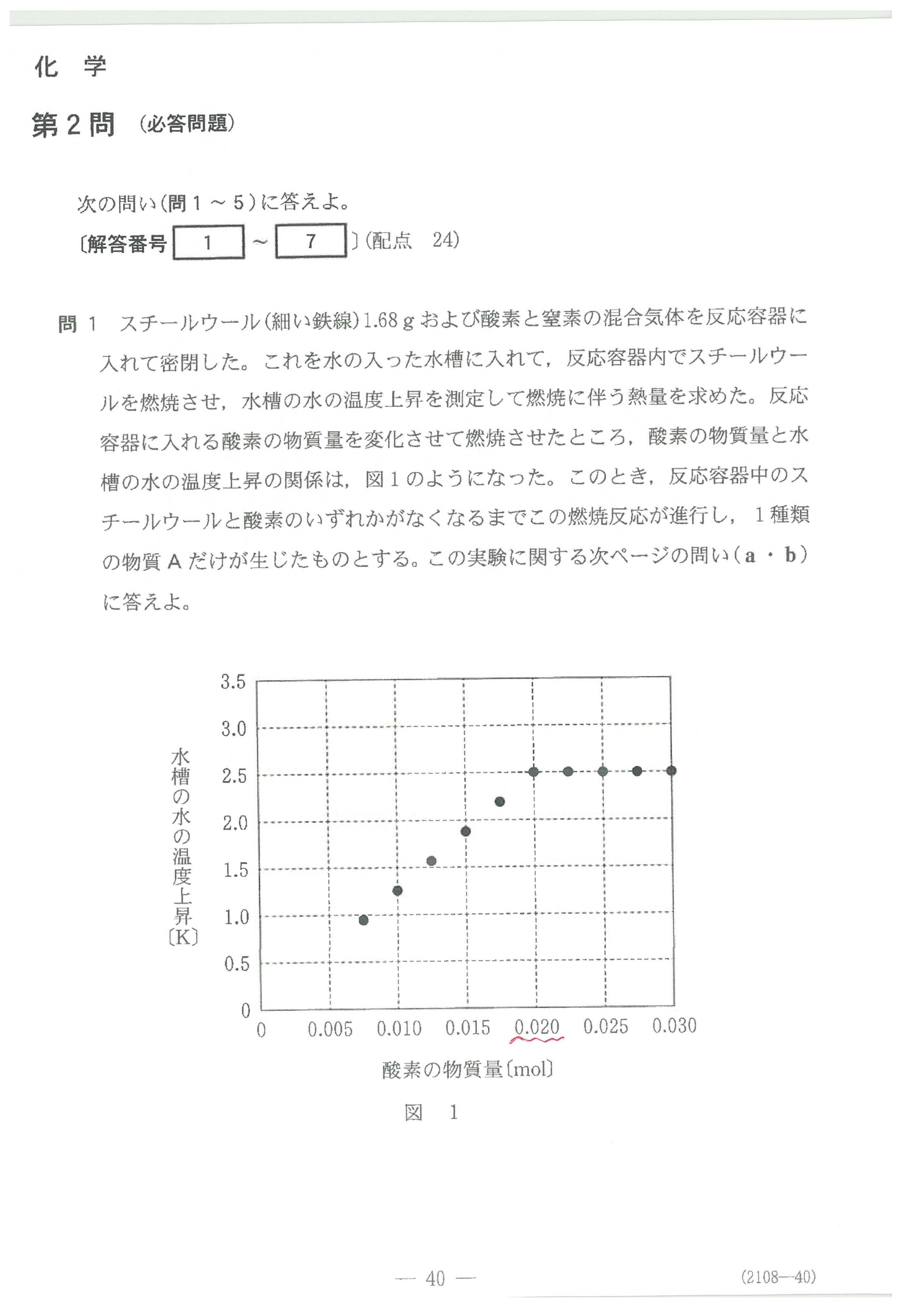
・第2問(問1)スチールウールの燃焼生成物
鉄が燃えると、酸化数の一番大きなFe2O3になると考えないか?
スチールウールの燃焼物の色は鉄さび(主成分Fe2O3)ではなく、フェライト磁石(成分Fe3O4)の色と同じですよね?
ヒントはこれくらいかな・・・
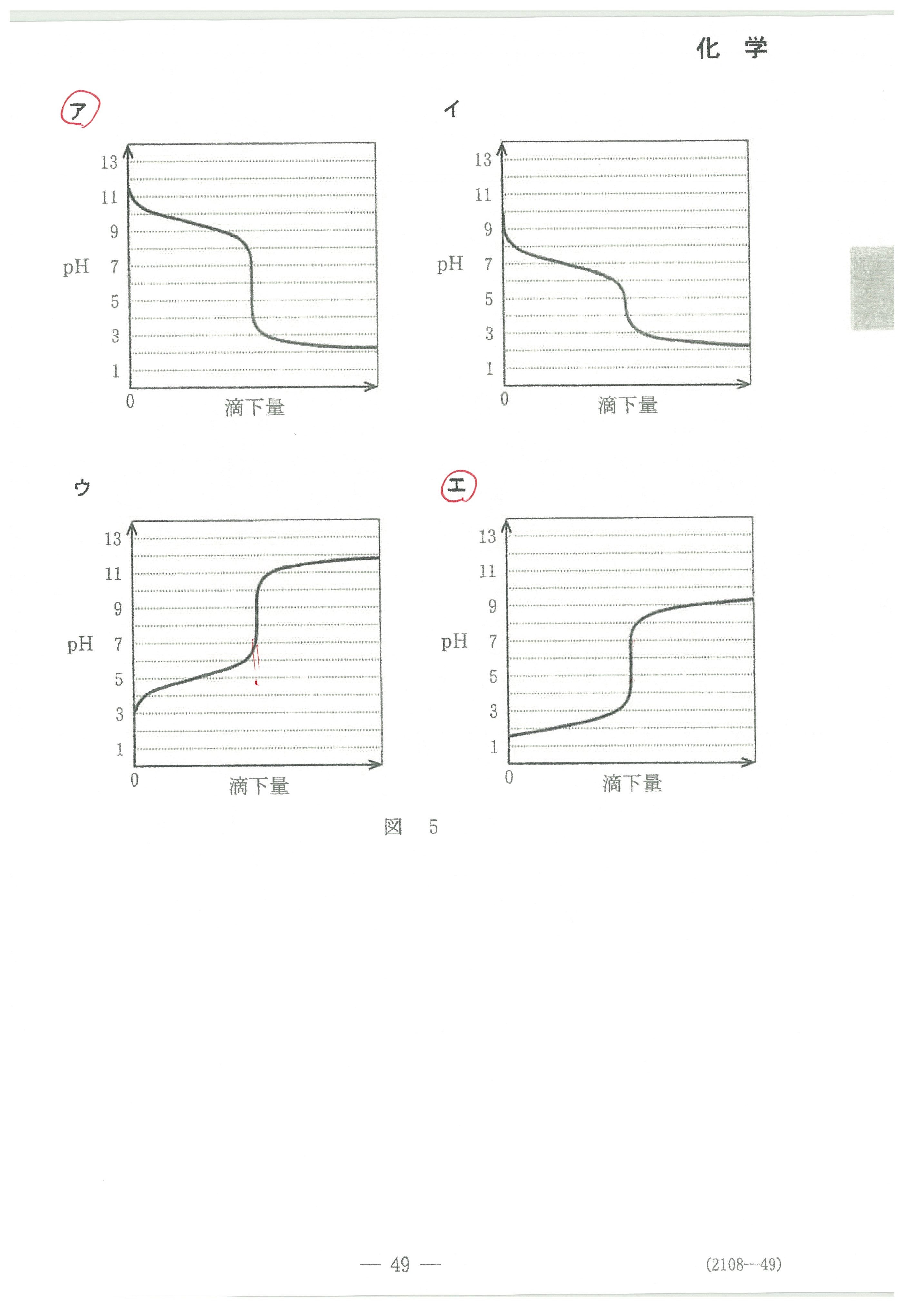
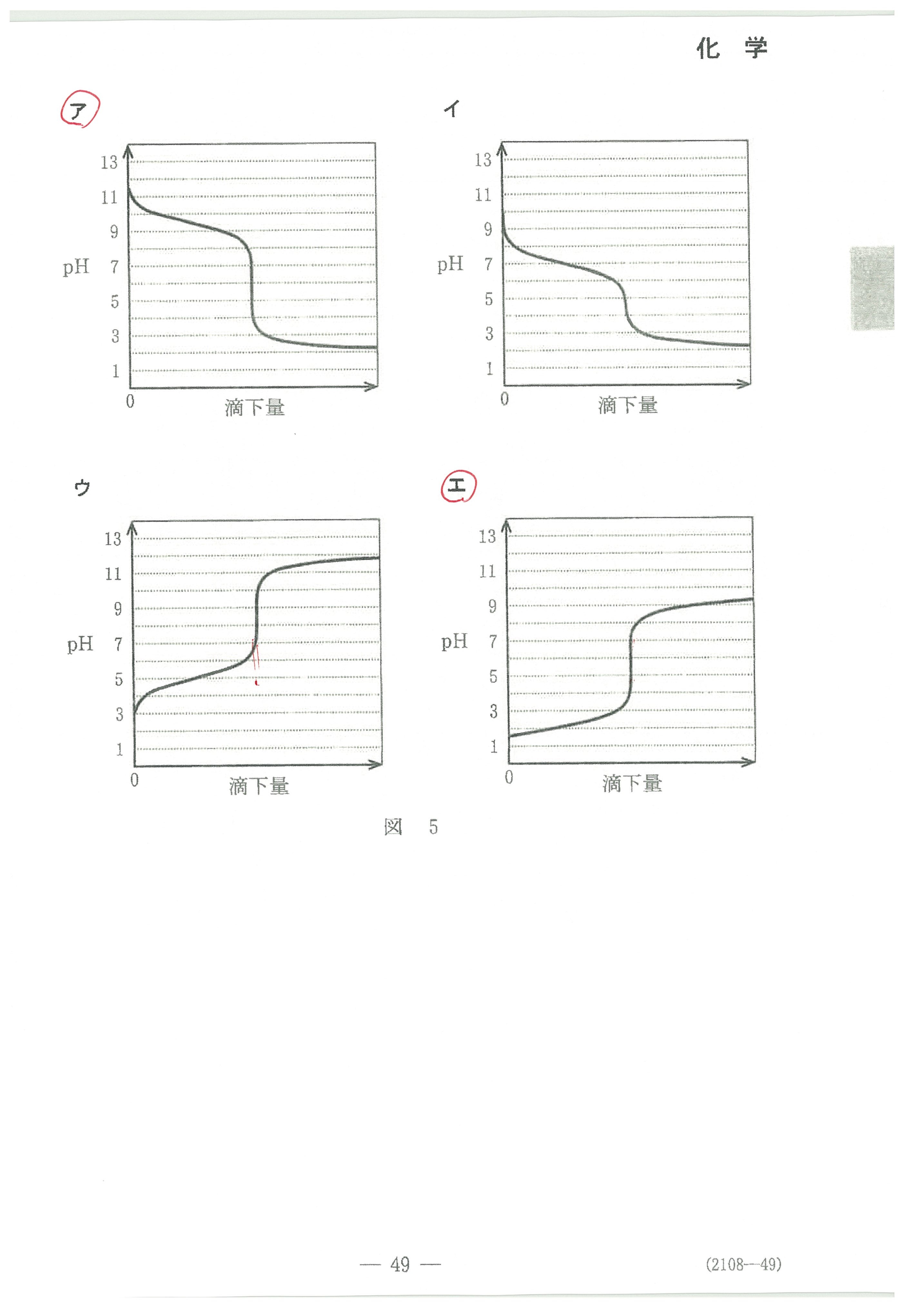
・第2問(問5)指示薬についての珍しい出題。これが一番とまどう?
以上のように式を変形して考えれば難しくないのですが、初めて見るたぐいの問題は焦ると思います。
・第3問(問5)充電池の問題ですが、酸化還元の反応式は不要
前述の反応式は使わずに出来るんですが、これも見かけない問題でちょっととまどうと思います。
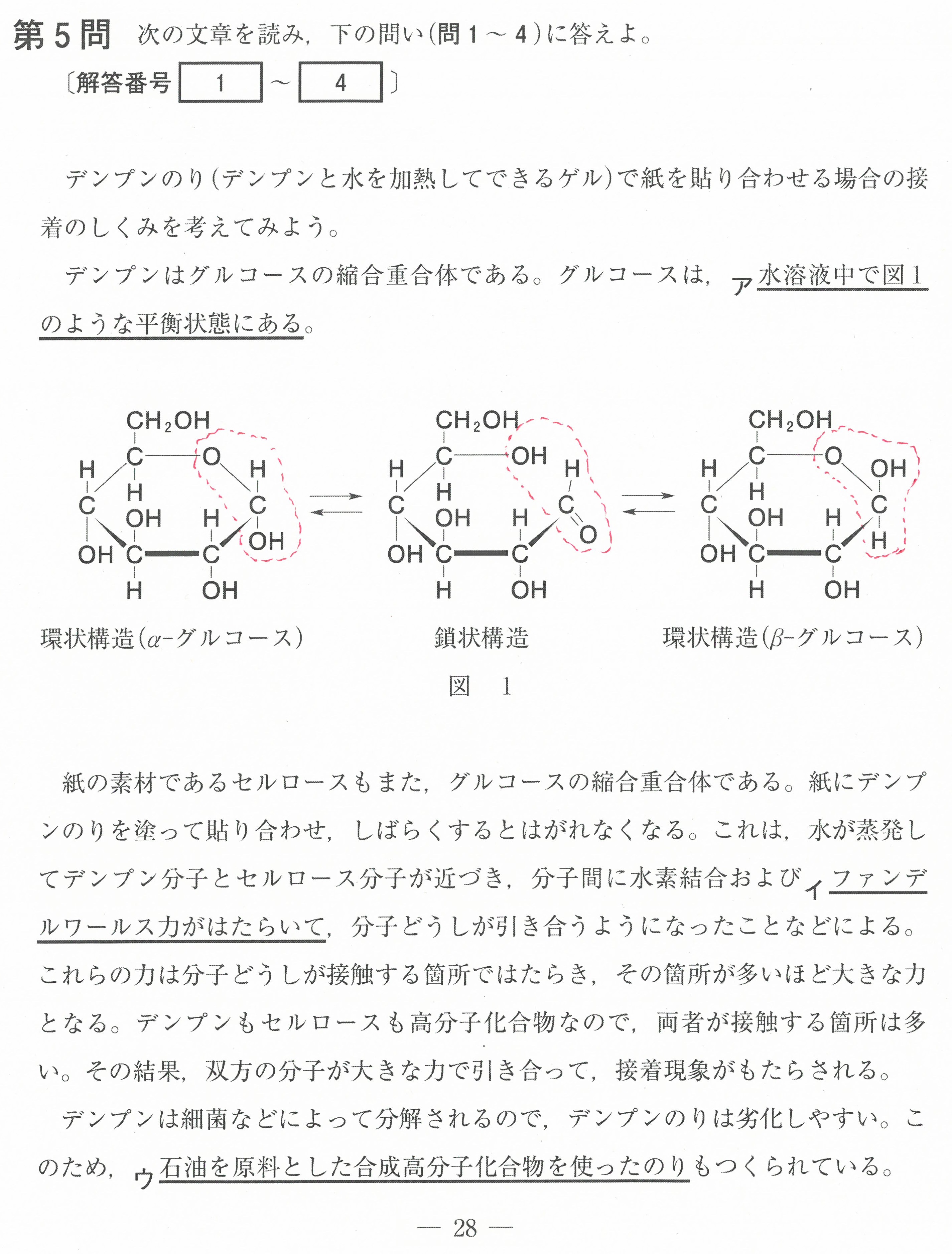
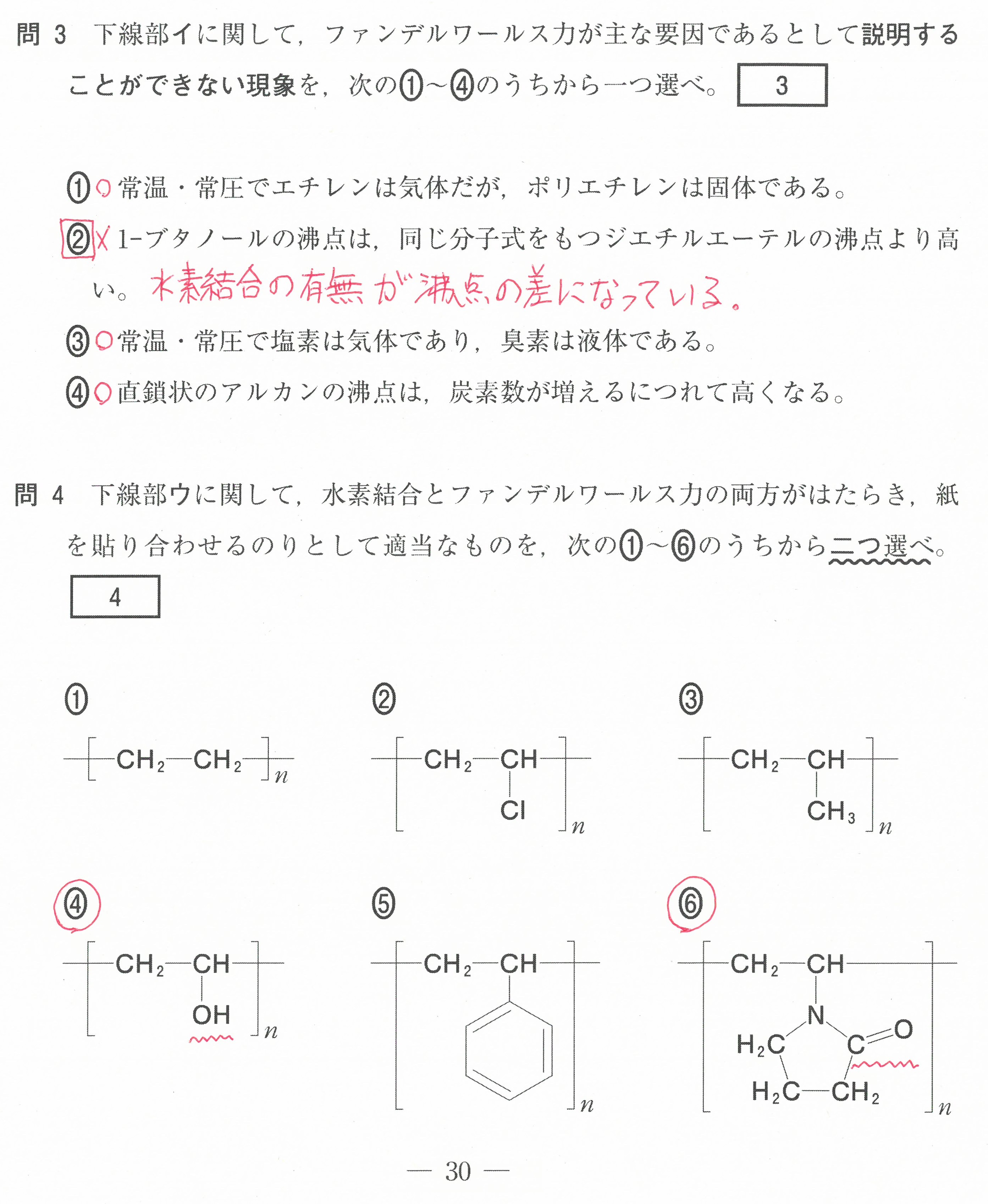
・第6問(問1)選択問題。ポリイソプレンについて細かい記述
ポリイソプレンのシス形、トランス形についても教科書には載っていないのでは?
(数研の教科書には、参考資料として載っていました)
この問題では、この選択肢以外が正しいとしっかりと判断できると思うので、大丈夫だと思うんですが・・・
・第7問(問2)選択問題。デキストリンの加水分解は途中まで
完全に加水分解すると、グルコースが生成しますが、アミラーゼを使って加水分解させるので、加水分解はマルトースまでしか進みません!
2020 センター「化学基礎」本試 ここが出来てれば満点!
・第1問(問6)
CaCl2 + CaBr2 + 2Na2SO4 → ・・・ と反応式を書いたらダメですよ!
こう書いてしまうと、CaCl2 と CaBr2は同じ物質量になってしまいます!
・第2問(問1)(問2)
(問1)
35Clを続けて2回取り出す割合を求めれば良い。
補足として、相対質量72のCl2の割合はいくつになるか? 計算してみて下さい!
ちょっと落とし穴がありますから注意して! (答 約36.5%)
(問2)
溶質の量だけに着目すれば簡単です!
・第2問(問3)
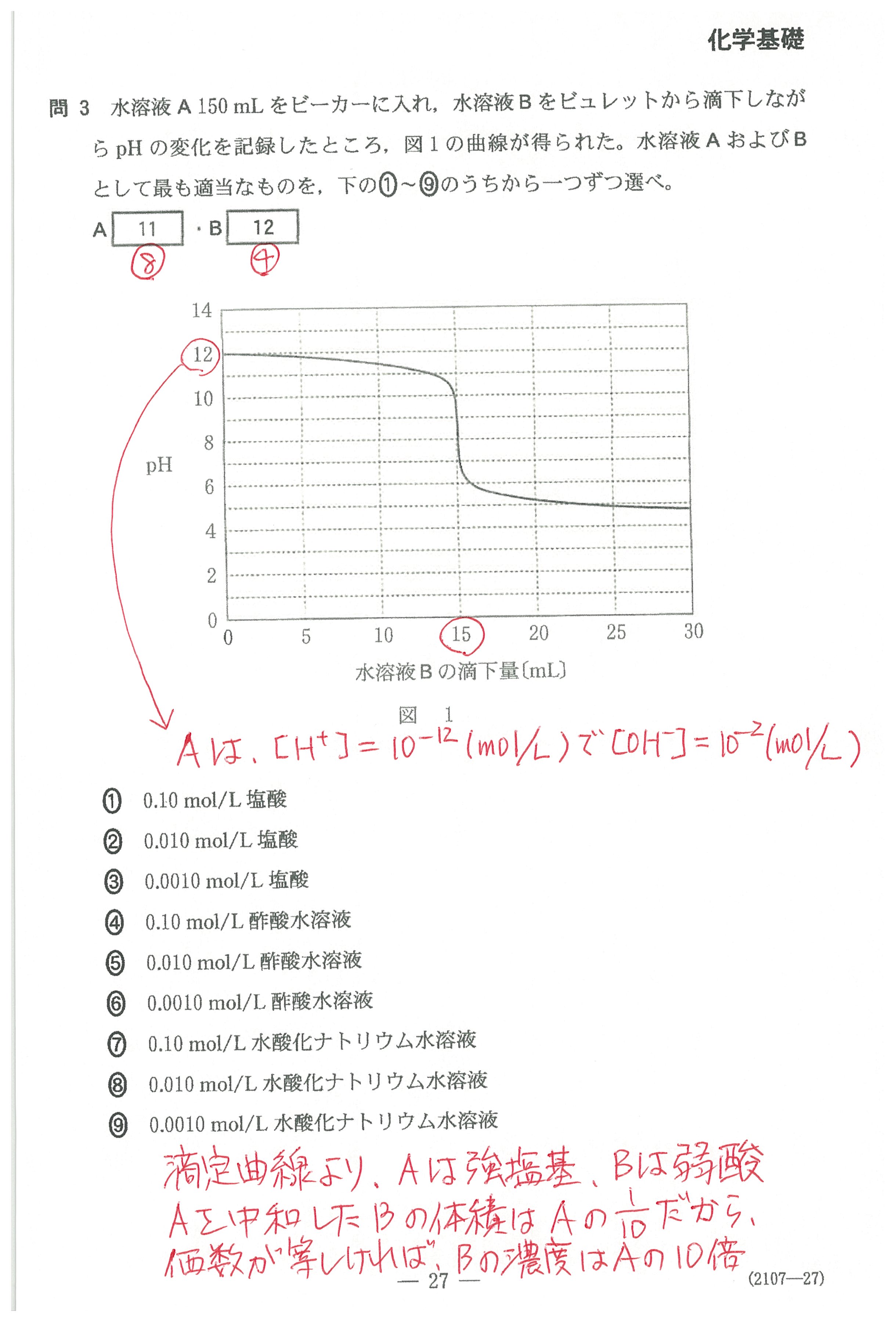
滴定曲線の始まる位置に注目。これで塩基の[OH-]が分かりますね。
2020 センター「化学」本試・解答解説
・第1問(問1)
・第1問(問2)
・第1問(問3)

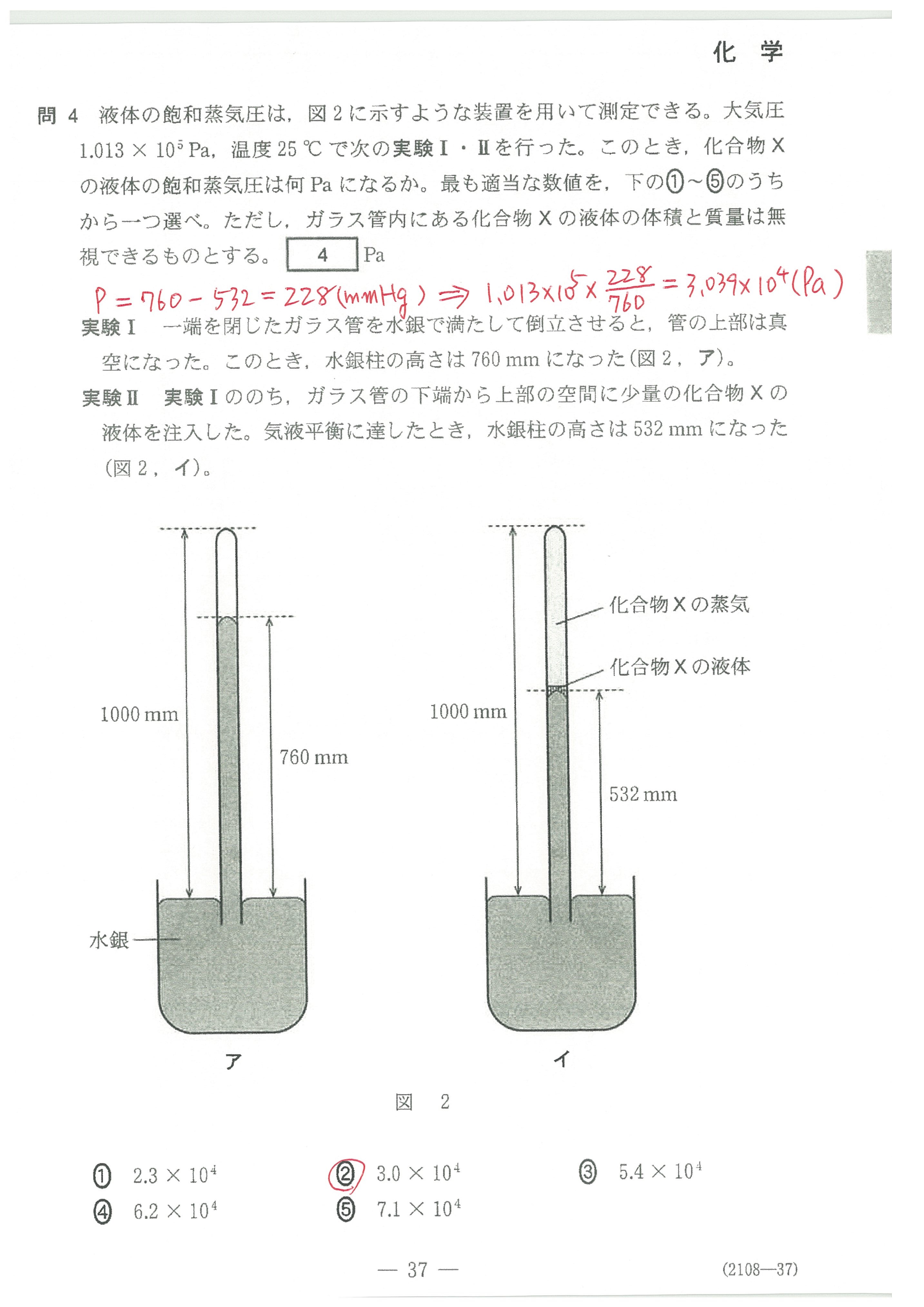
・第1問(問6)
・第2問(問1)
・第2問(問2)

・第2問(問4)
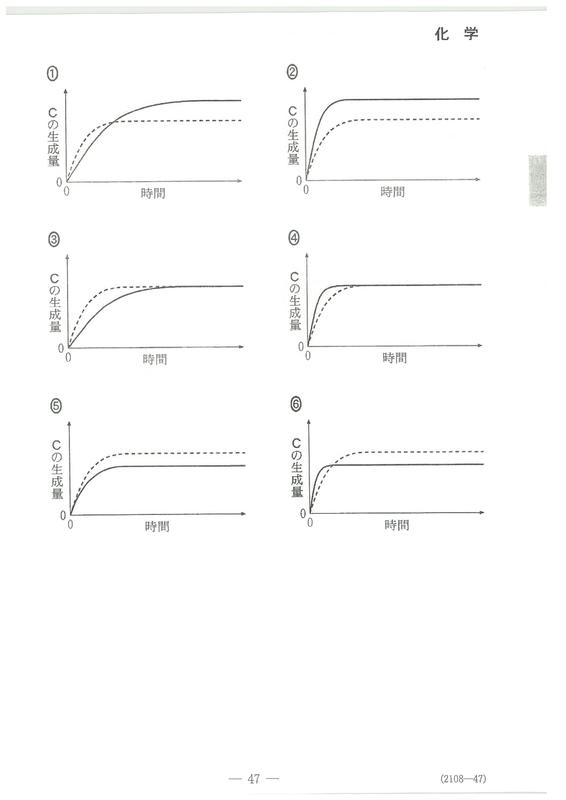
・第2問(問5)
・第3問(問1)
・第3問(問2)
・第3問(問3)
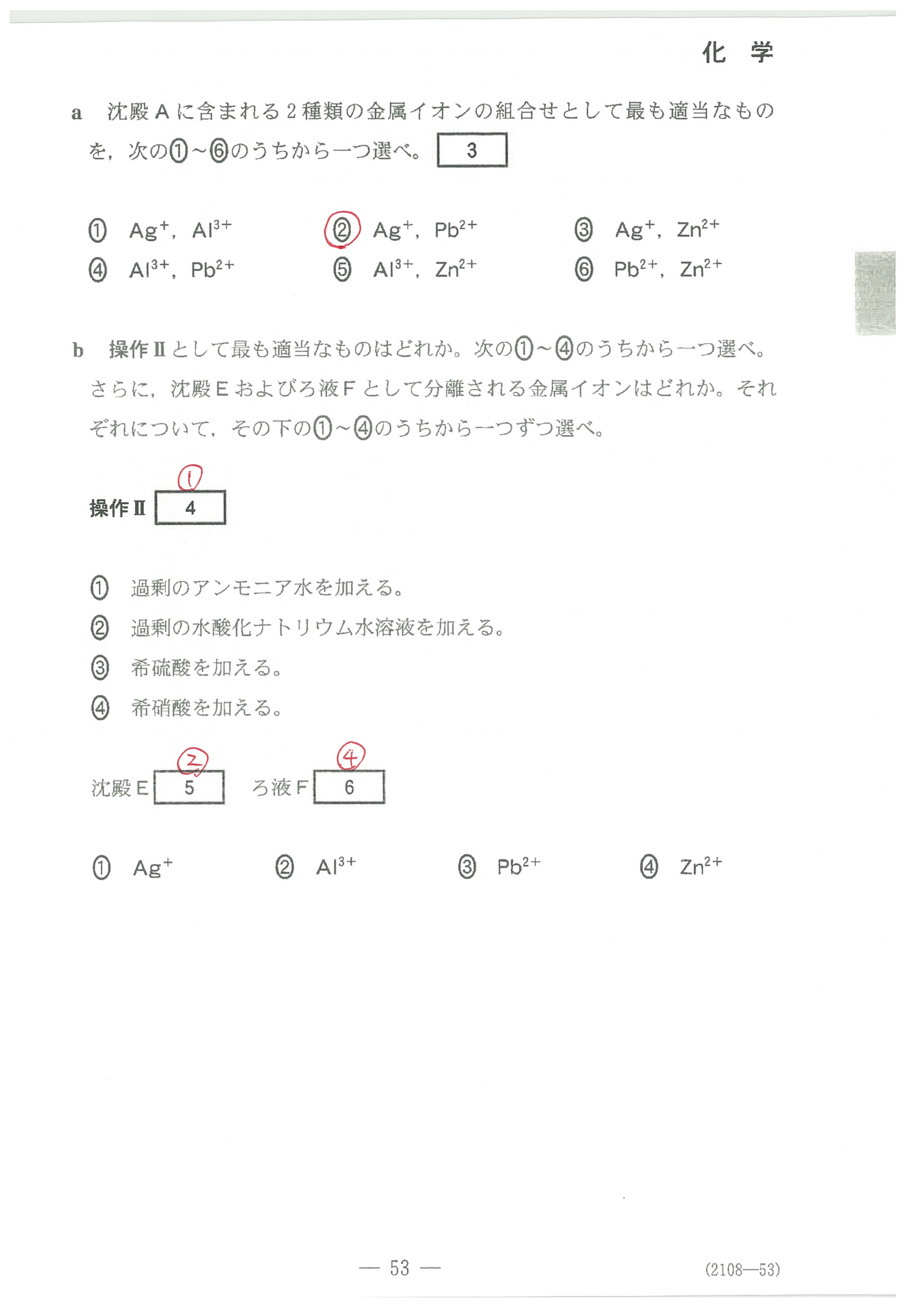
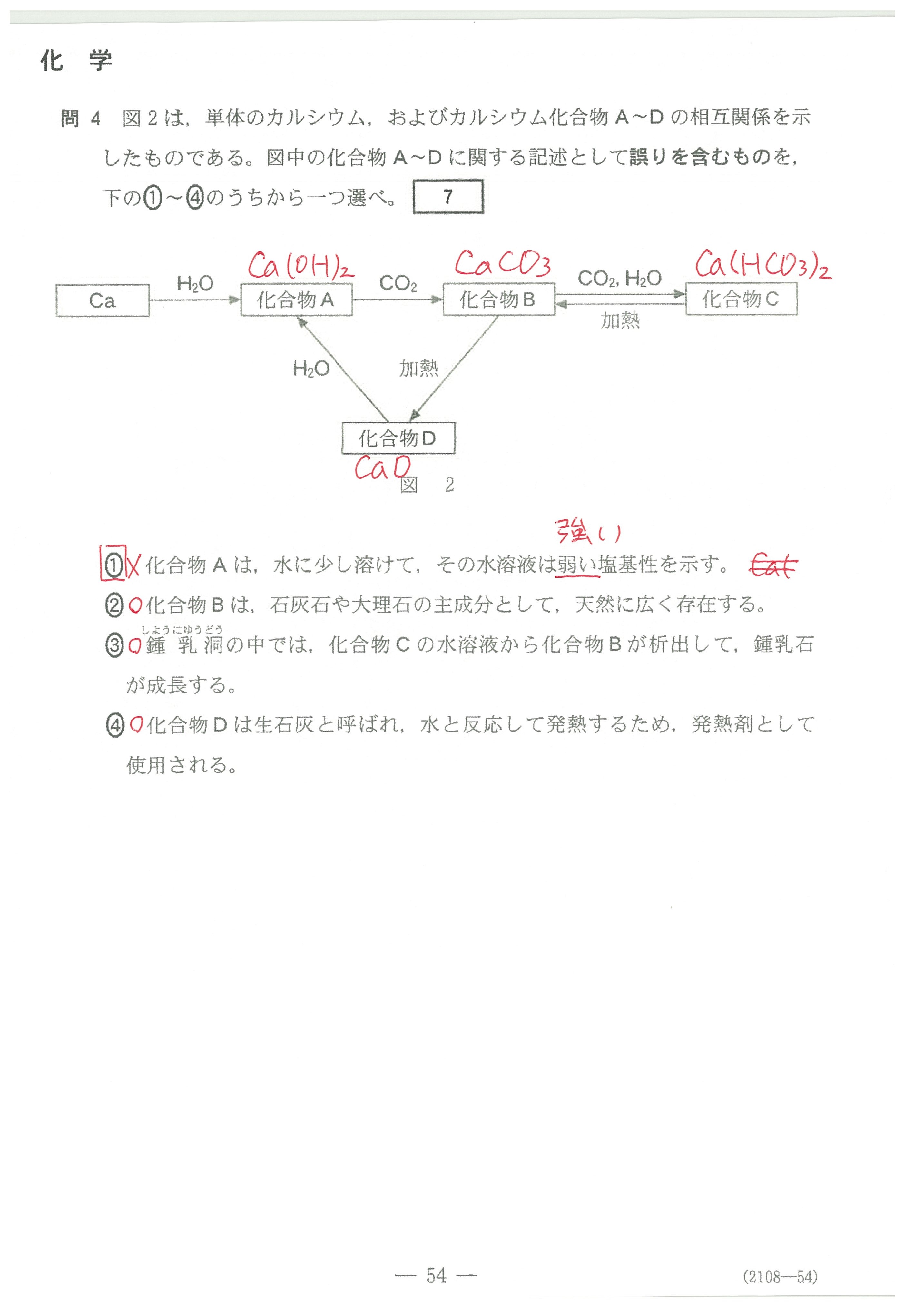
・第4問(問1)(問2)

・第4問(問5)
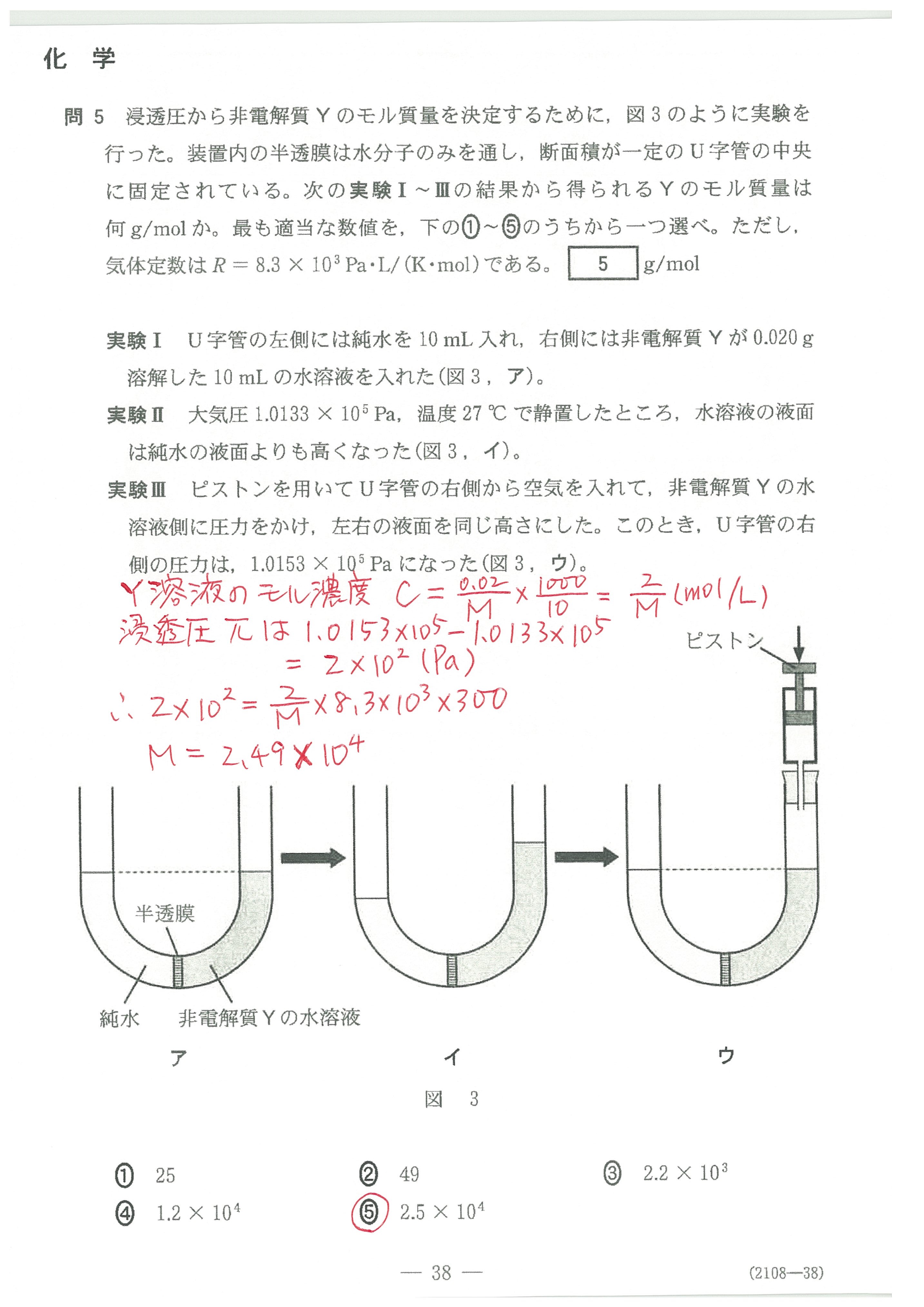
・第5問(問1)
・第5問(問2)
・第6問(問1)選択
・第6問(問2)選択
・第7問(問1)選択
・第7問(問2)選択
このウェブサイトは、
NetCommons3.3.7で動いています。
NetCommons プロジェクト 開発の、
CMS+グループウェアです!
| 日 | 月 | 火 | 水 | 木 | 金 | 土 |
1 | 2 | 3 | 4 | 5 | 6 | 7 |
8 | 9 | 10 | 11 | 12 | 13 | 14 |
15 | 16 | 17 | 18 | 19 | 20 | 21 |
22 | 23 | 24 | 25 | 26 | 27 | 28 |
29 | 30 | 31 | 1 | 2 | 3 | 4 |