共通テスト試行問題「化学基礎」H30年公表_解答解説
第1問(問1)
この問題では、解答するのに必要な情報は、赤下線の部分だけです。
文章のどの部分が解答に必要な情報なのかを探すトレーニングが、新たに必要になると思います。
このように情報が多く書かれている場合は、まず設問を読んでから、記述文を読んでいくようにすると良い。
第1問(問2)
①については、食塩水の沸点は純水の沸点より高いという記述が教科書にあるが、凍る温度(凝固点)は、これから推測するしかない?
ただ、食塩水が凍る温度は純水の凍る温度より低いということは、中学校以前に教わっているのでは?
第1問(問3)
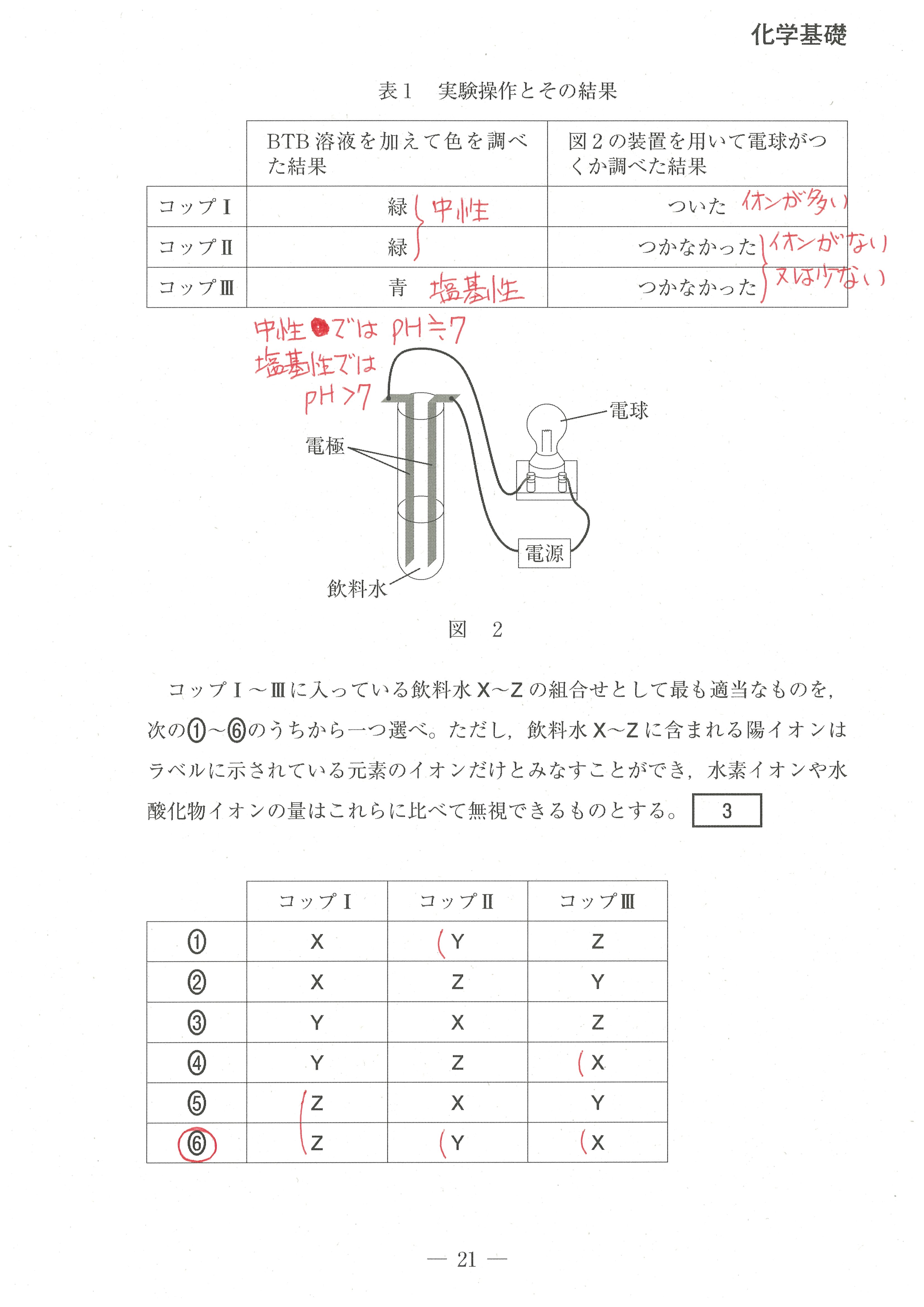
水中のイオンの量が多いと電気を導きやすくなるが、溶液X、Y、Z中のイオンの量をざっと比較して判定する。
この、「ざっと比較すること」に慣れていって欲しいと思います。
第1問(問4)
センター試験同様の設問。
教科書の基本的内容についての問い。
第1問(問5)

教科書の基本的内容についての問い。
ただし、出題分野は、序章の「化学と人間生活」から。
これまでのセンター試験でも、この分野からの出題はあったので、この分野もしっかりと習得しておきましょう。
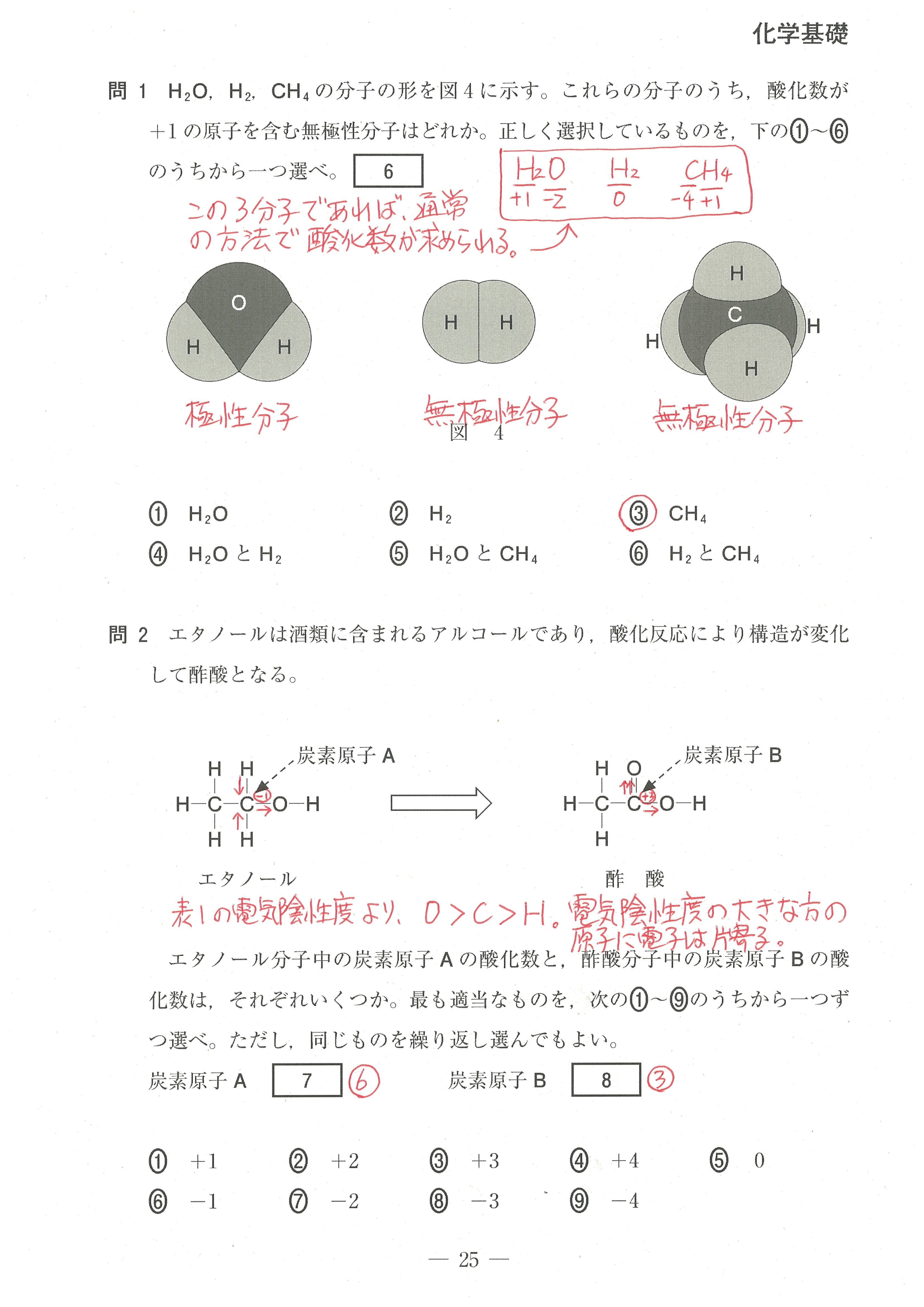
第2問(問1)(問2)
この設問は、難しく感じるかもしれないが、「電気陰性度の大きな原子が電子を強く引きつけ、電気陰性度の値が大きいものほど電子を強く引きつける」ということから考えていけば良い。
電気陰性度の大きな原子が、単結合1つあたり1コの電子を引き寄せる(-1になる)。
二重結合1つあたりでは2コの電子を引き寄せる(-2になる)ということです。
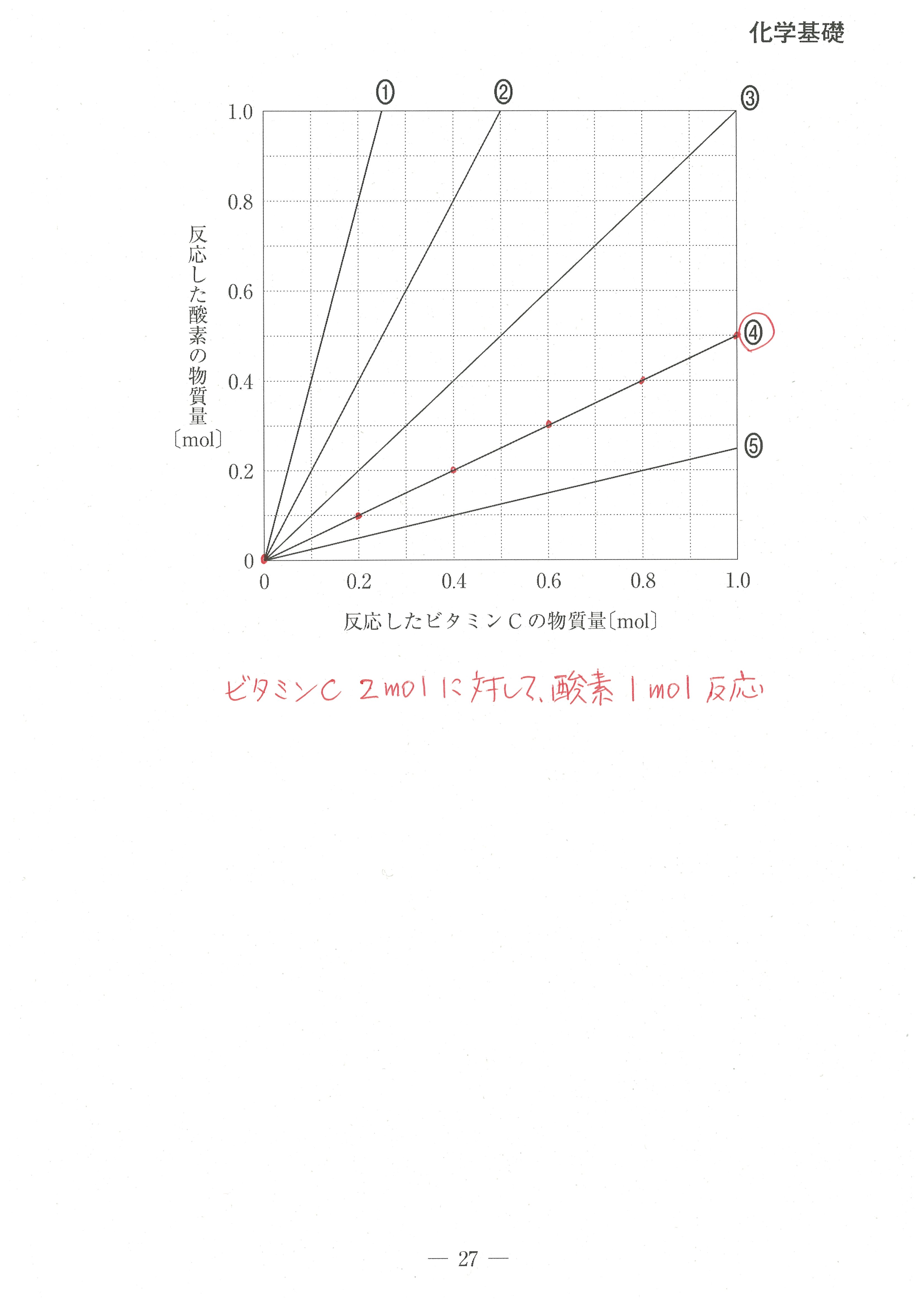
第2問(問3)
見慣れないビタミンCが出てきても、とまどわずに、解説のように式を書けば、反応するビタミンCと酸素の量関係が分かります。
あとは、グラフをキチンと読めればOK。
第3問(問1)(問2)(問3)

(問1)では、いつもの出題のように、試料溶液のモル濃度を中和滴定の公式で求めるのではなく、「実験に際して原液を何倍に薄めれば良いか?」という設問になっている。
これが目新しく、とまどうのではないか?
(問2)では、①~③はコニカルビーカー中のHClの濃度ではなく、HClの物質量を考えると分かりやすい。
④では、ビュレット先端の中の空気が押し出された時、ビュレットの液面が下がるので、読み取る滴下量が空気の分増えたことになってしまう。
第3問(問4)
(1)(2)の反応そのものは、化学基礎では学習していないが、問題文中で解説されているので、それに従って考えていけば大丈夫。
このウェブサイトは、
NetCommons3.3.7で動いています。
NetCommons プロジェクト 開発の、
CMS+グループウェアです!
| 日 | 月 | 火 | 水 | 木 | 金 | 土 |
23 | 24 | 25 | 26 | 27 | 28 | 1 |
2 | 3 | 4 | 5 | 6 | 7 | 8 |
9 | 10 | 11 | 12 | 13 | 14 | 15 |
16 | 17 | 18 | 19 | 20 | 21 | 22 |
23 | 24 | 25 | 26 | 27 | 28 | 29 |
30 | 31 | 1 | 2 | 3 | 4 | 5 |