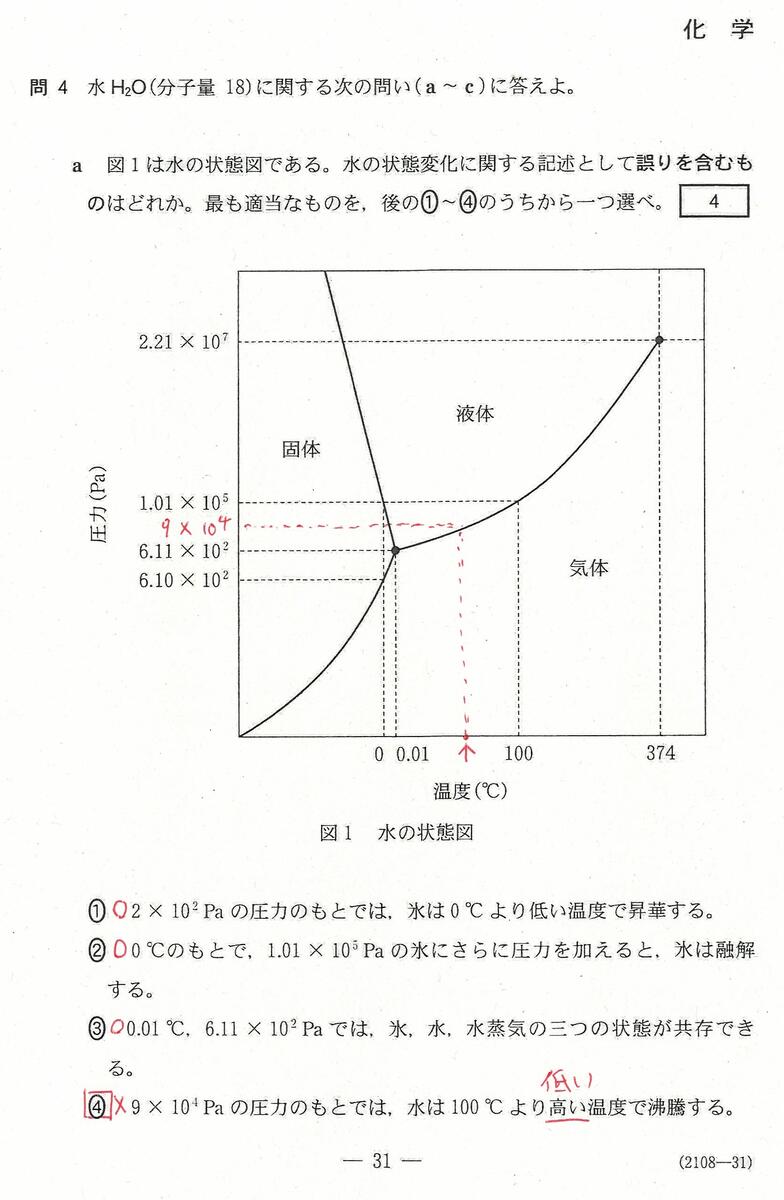
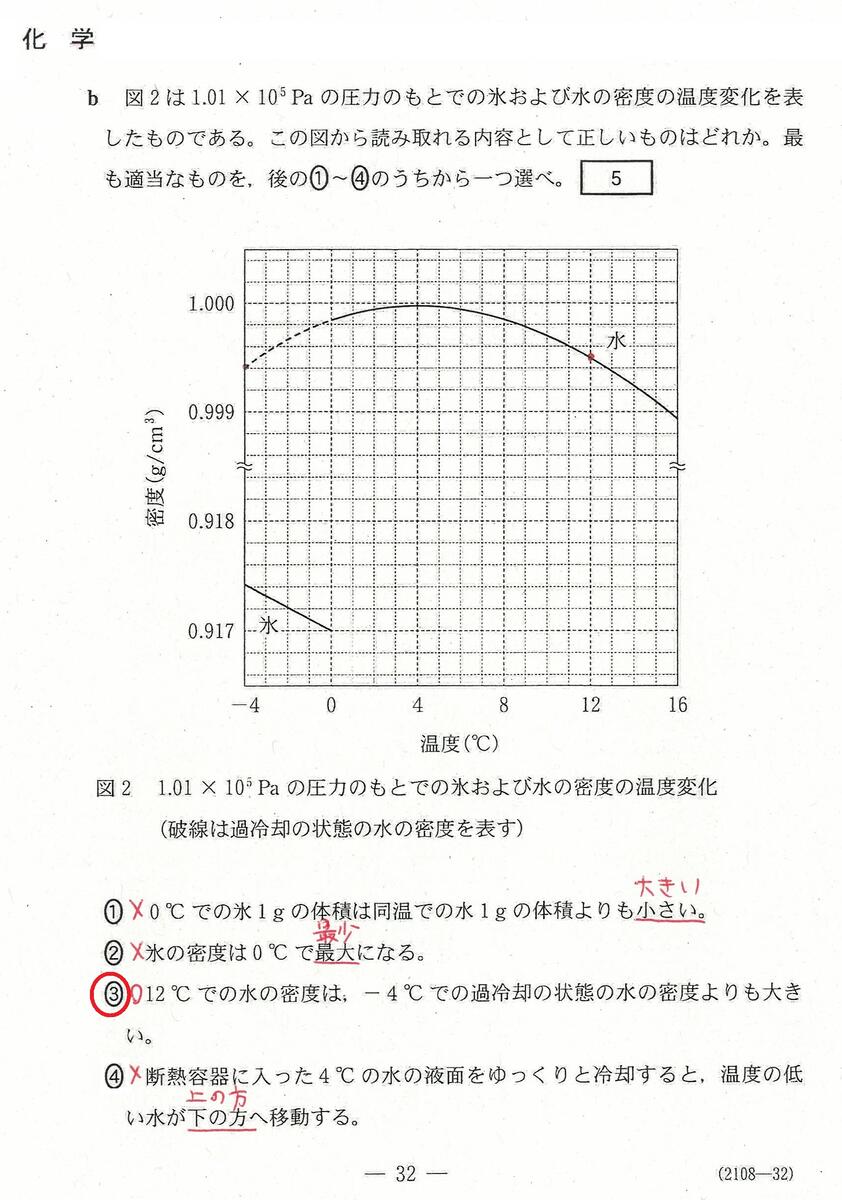
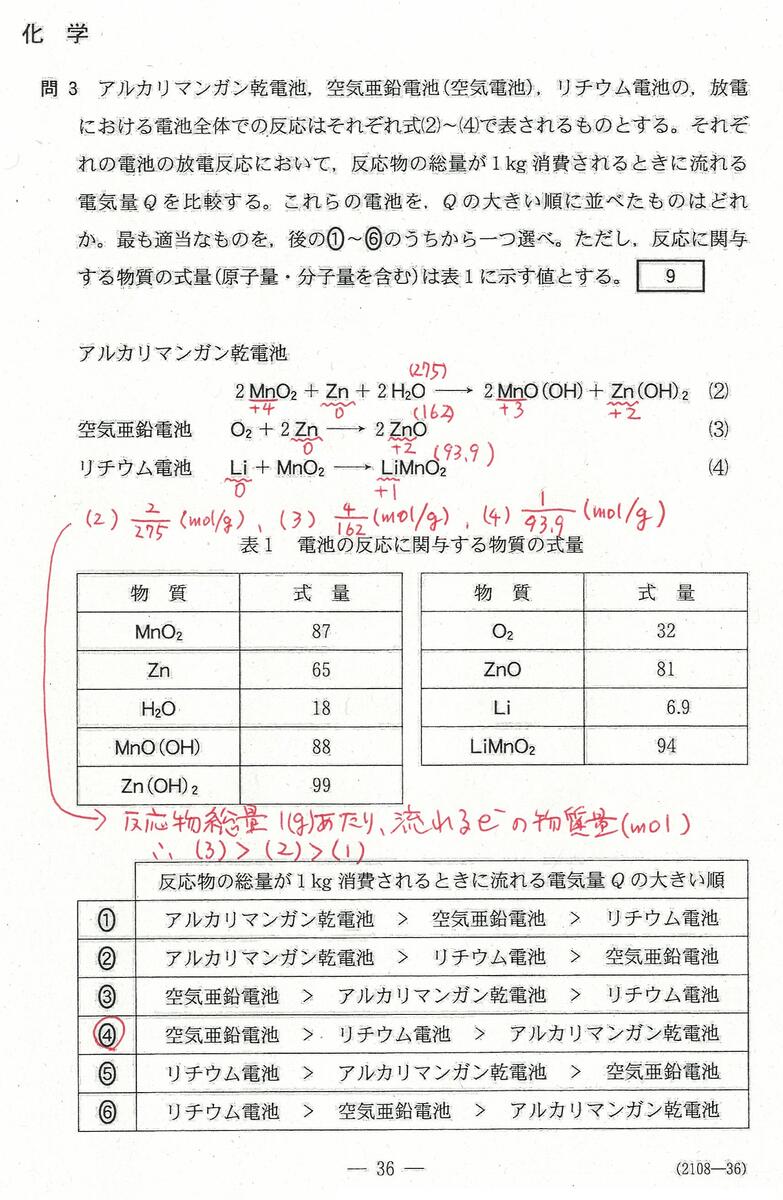
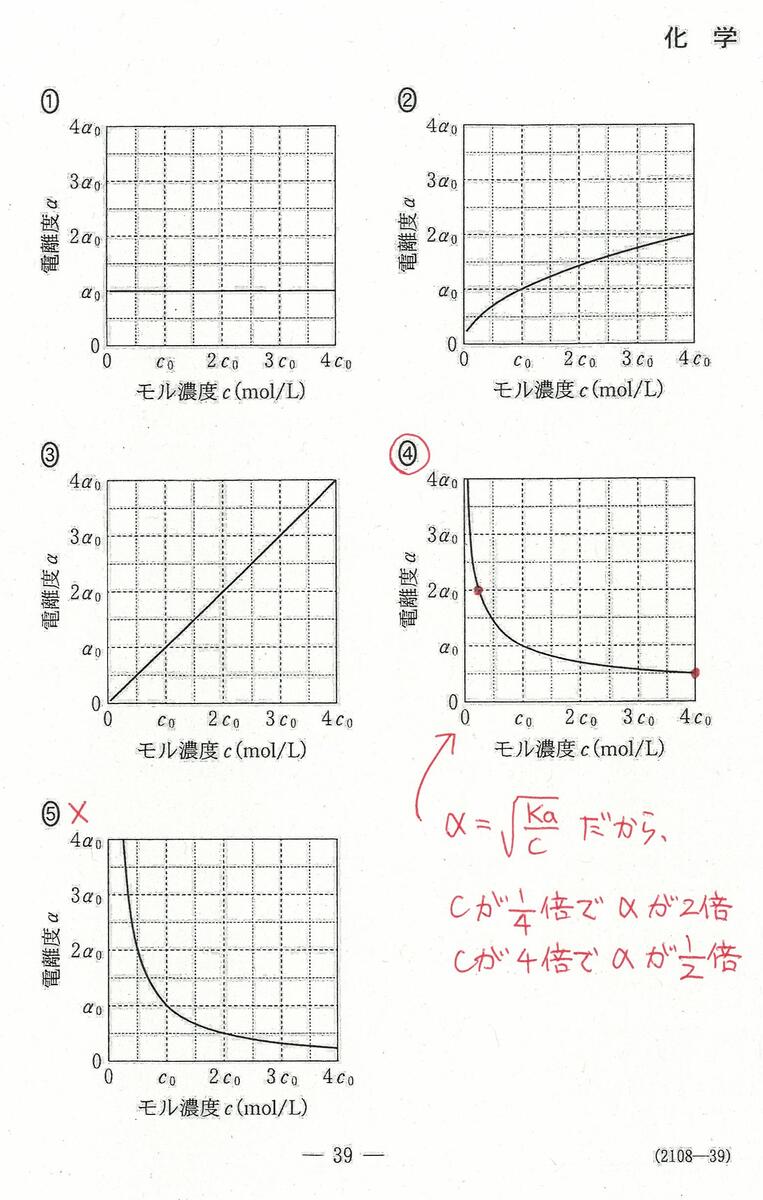
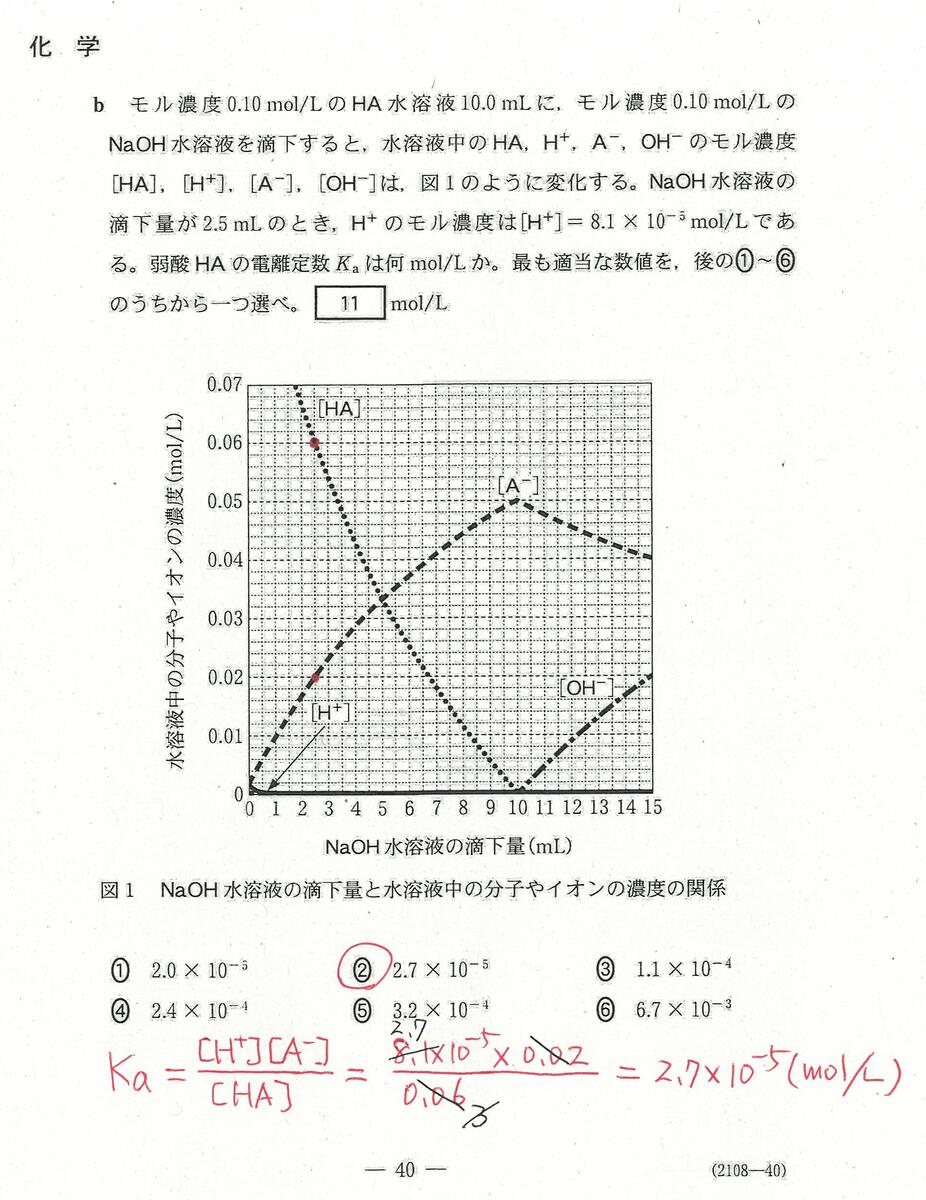
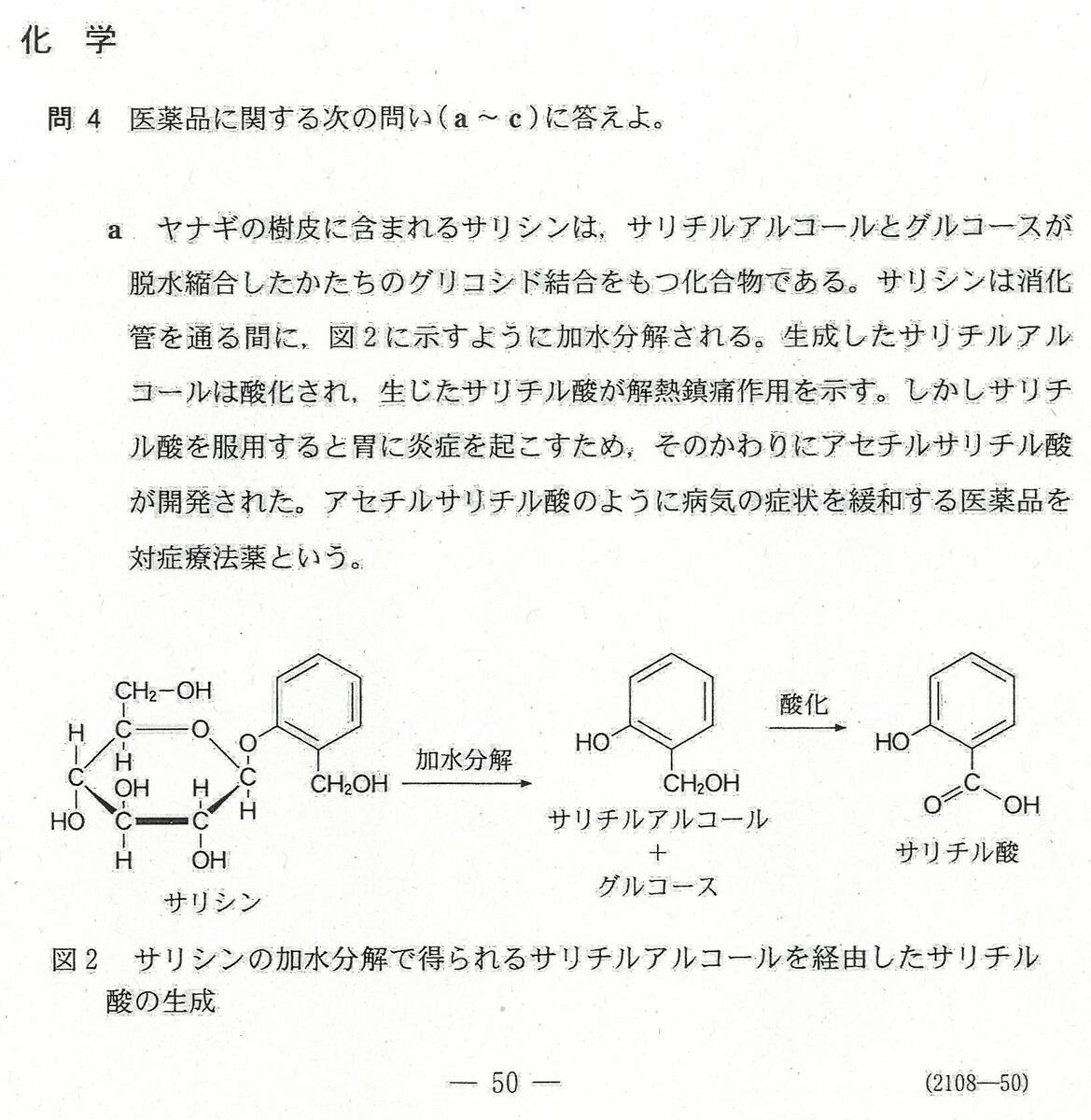
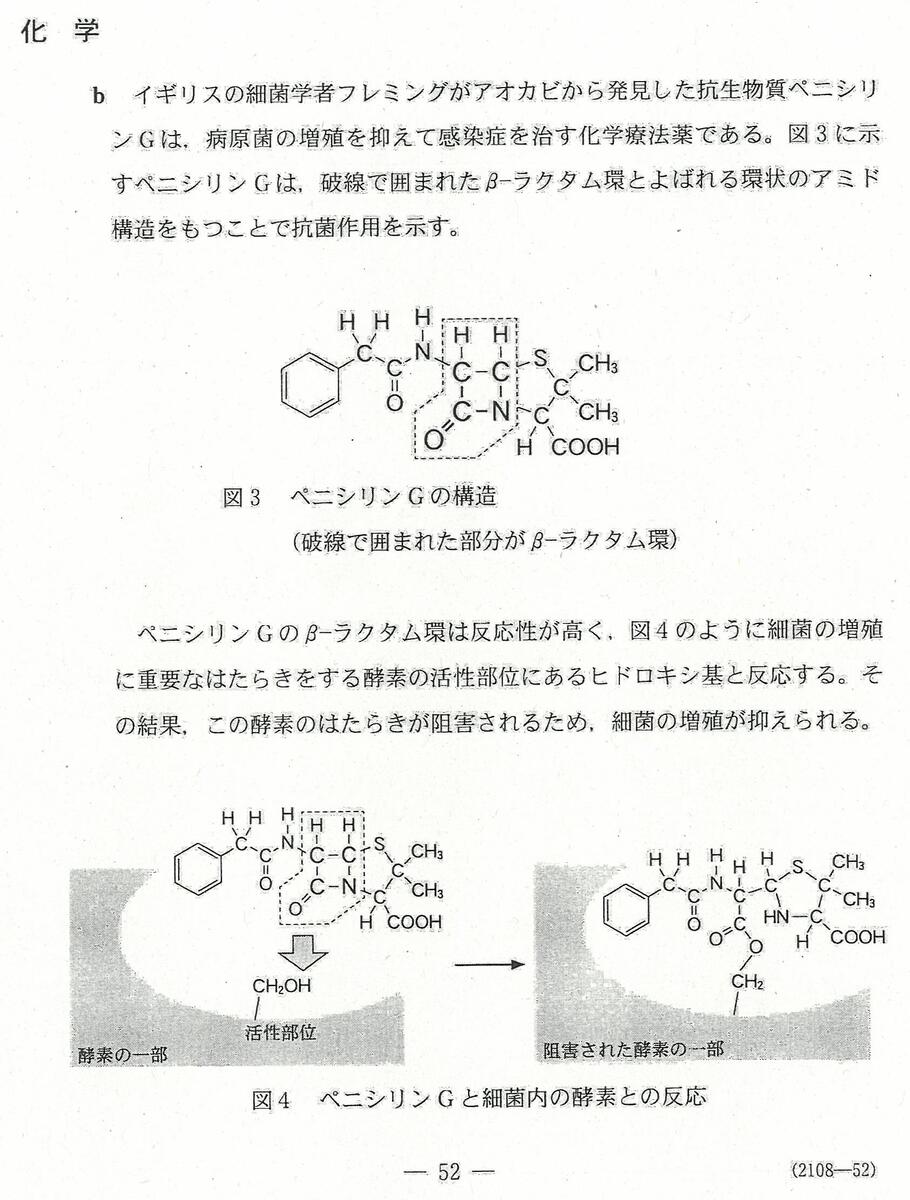
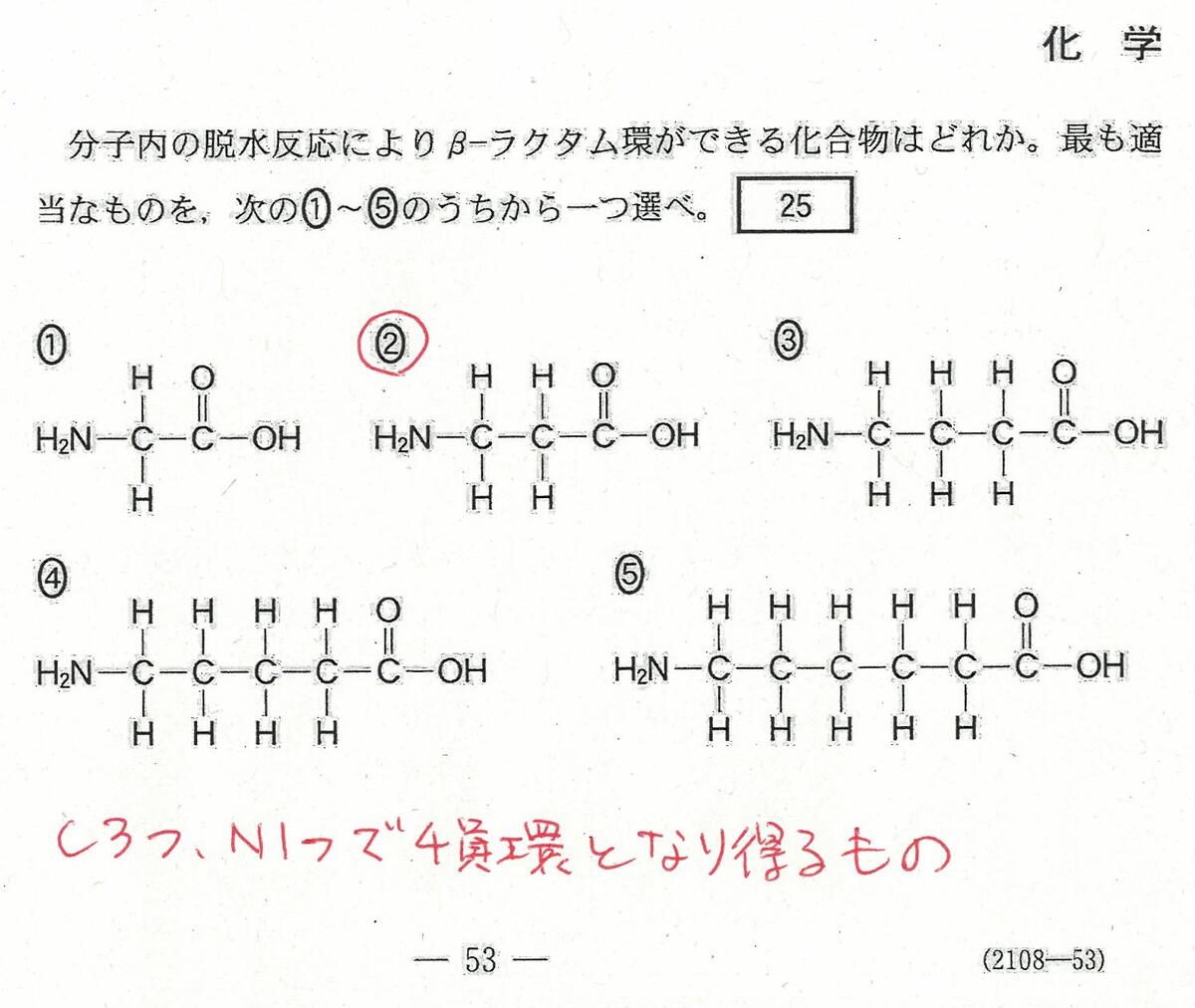
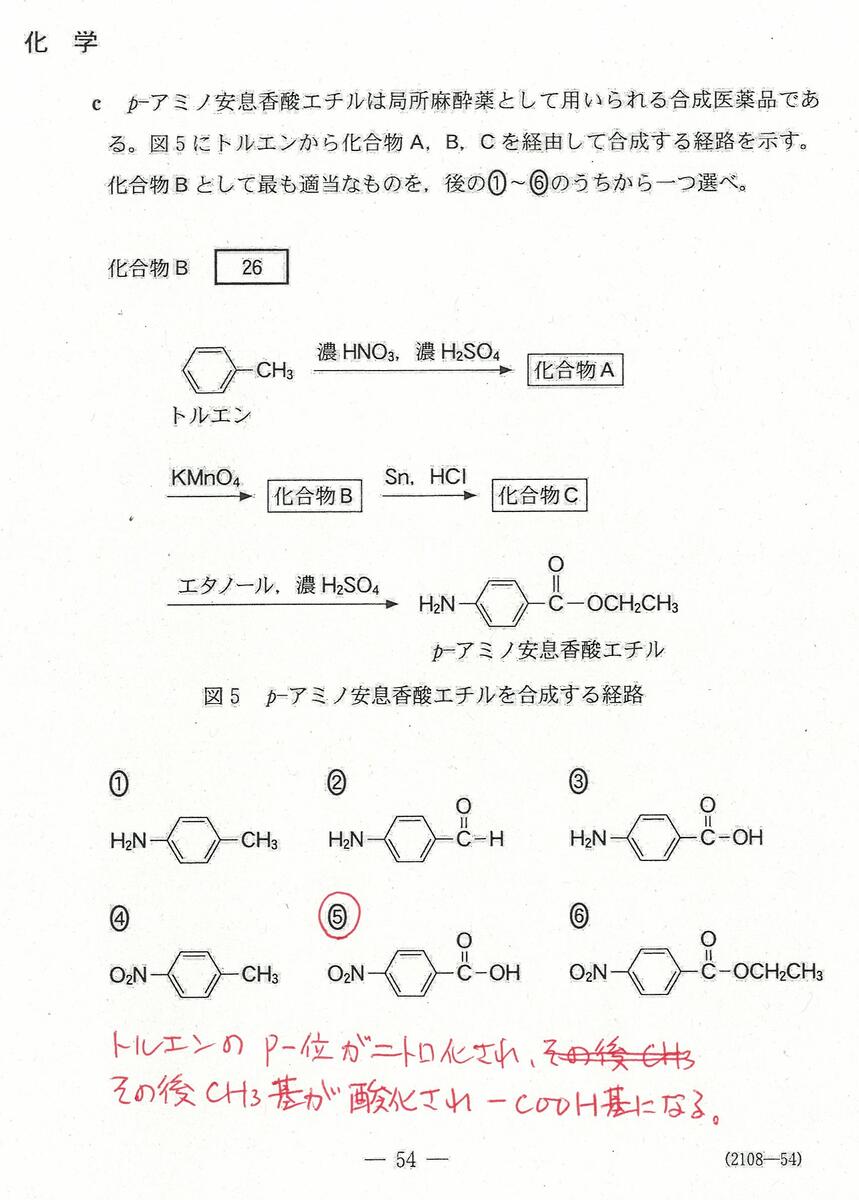
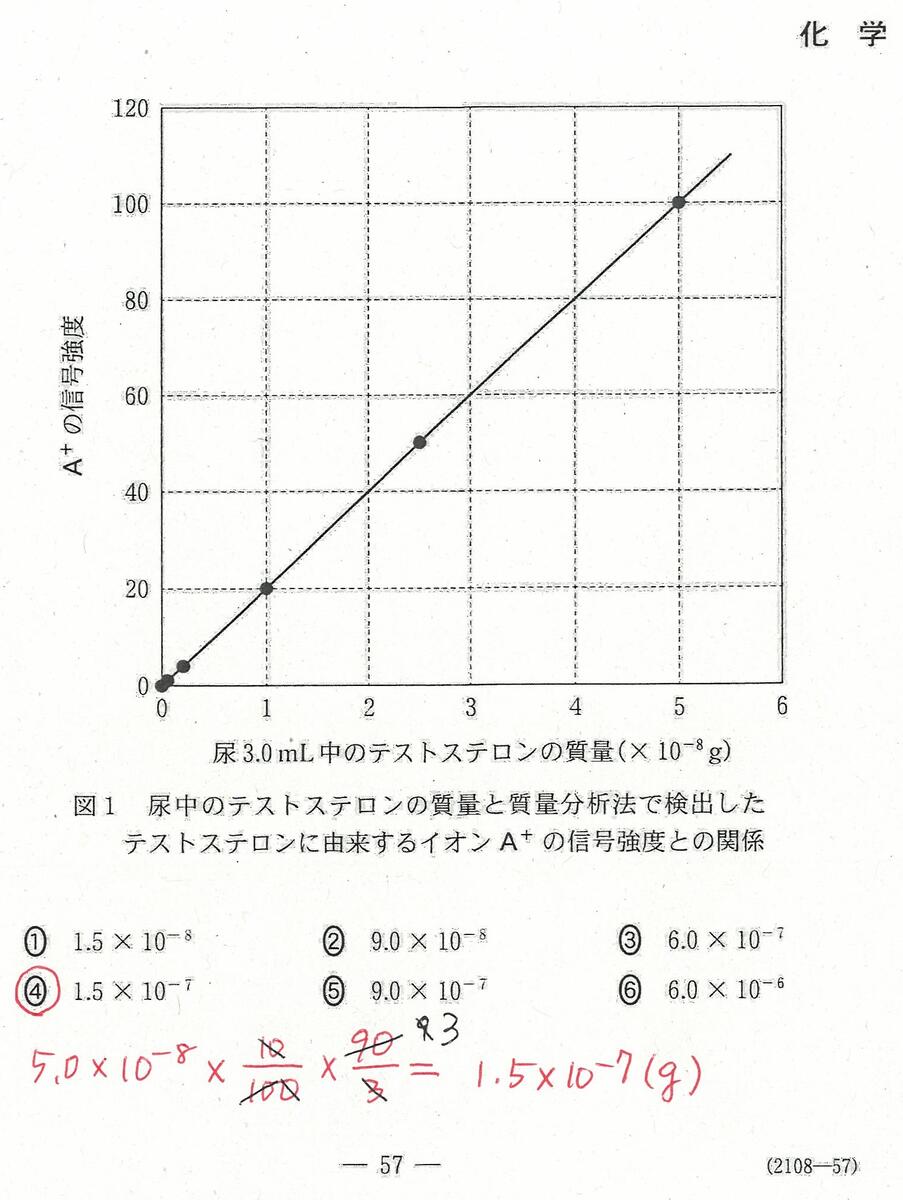
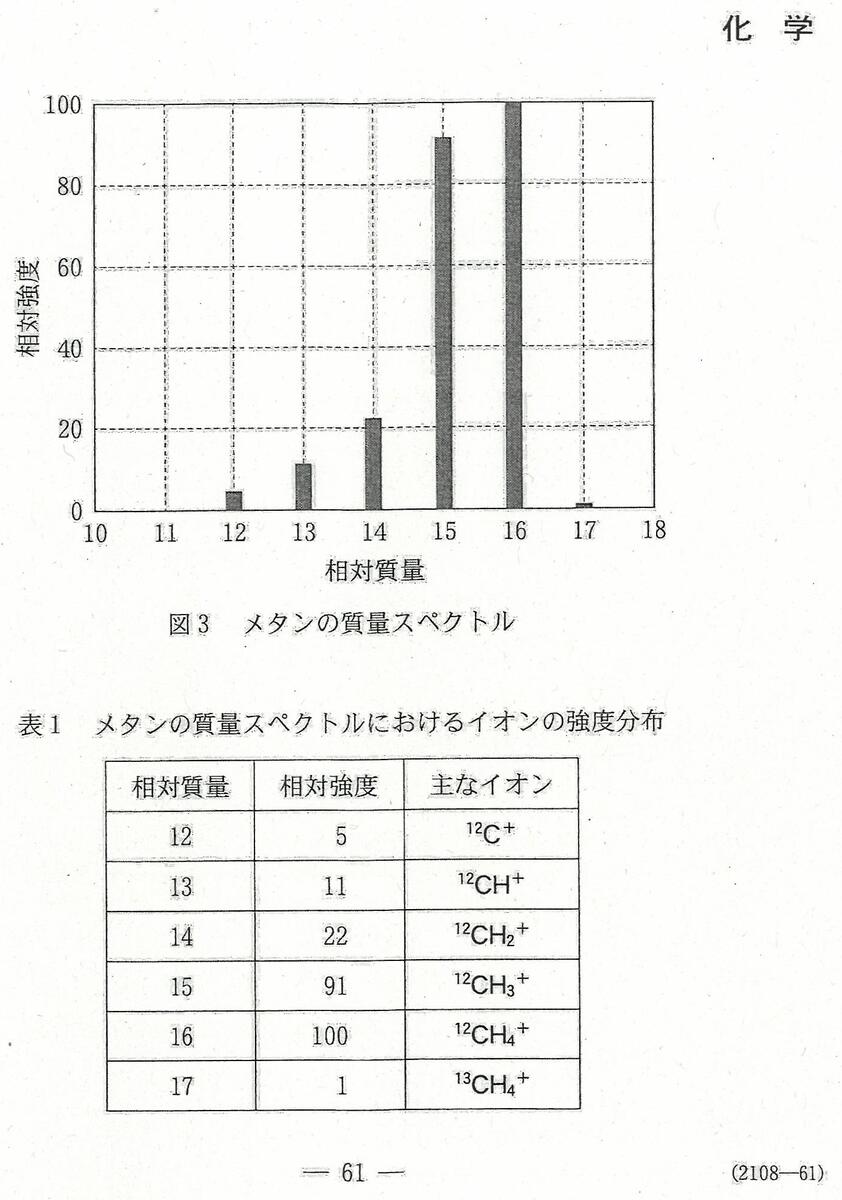
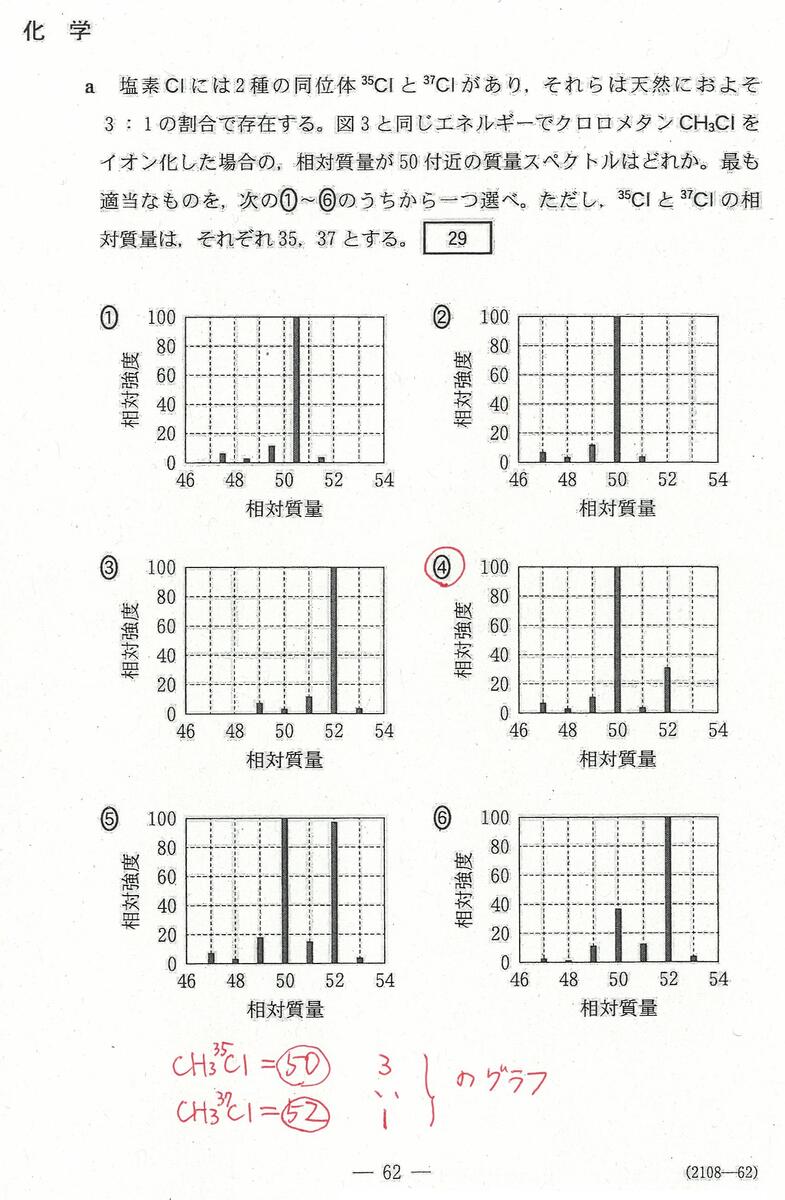
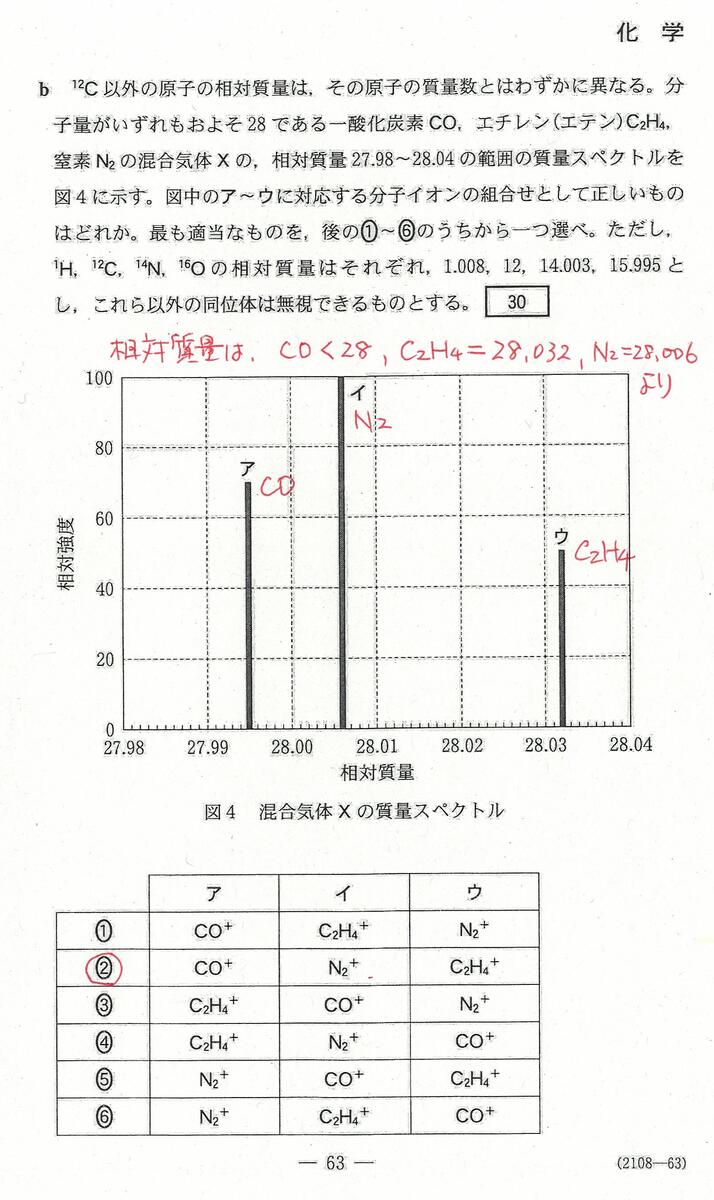
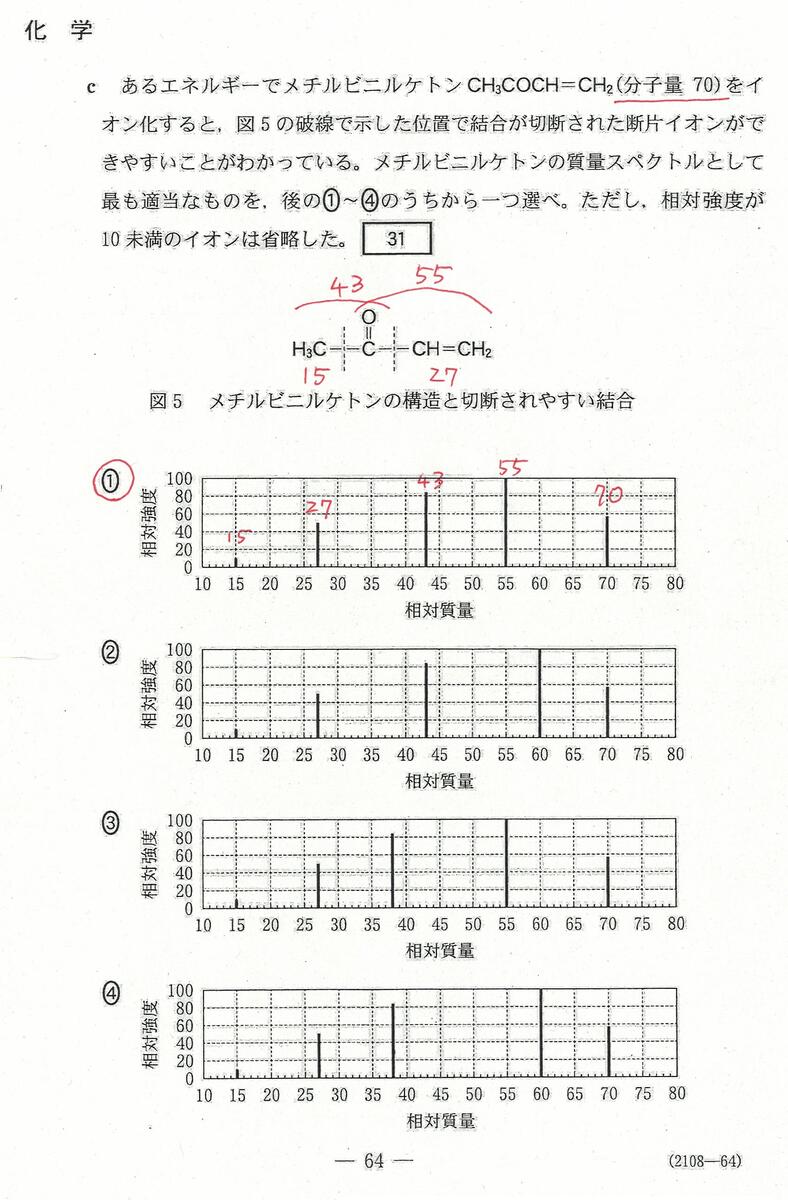
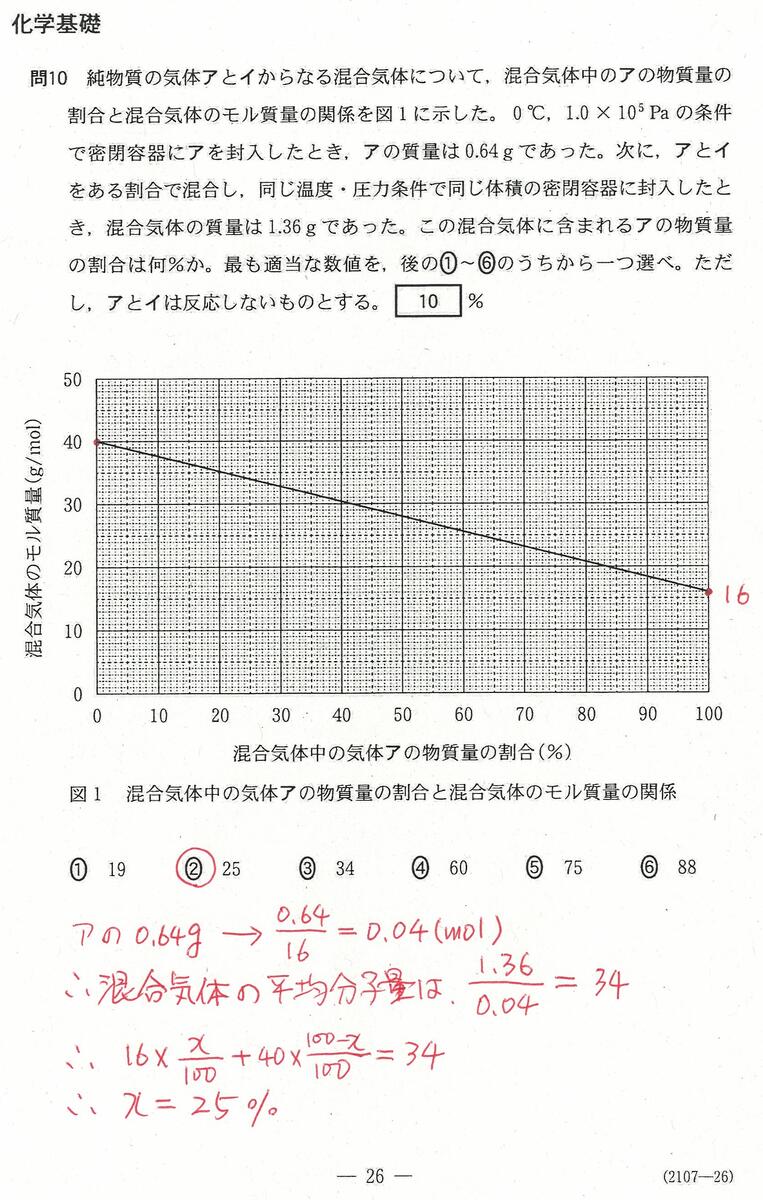
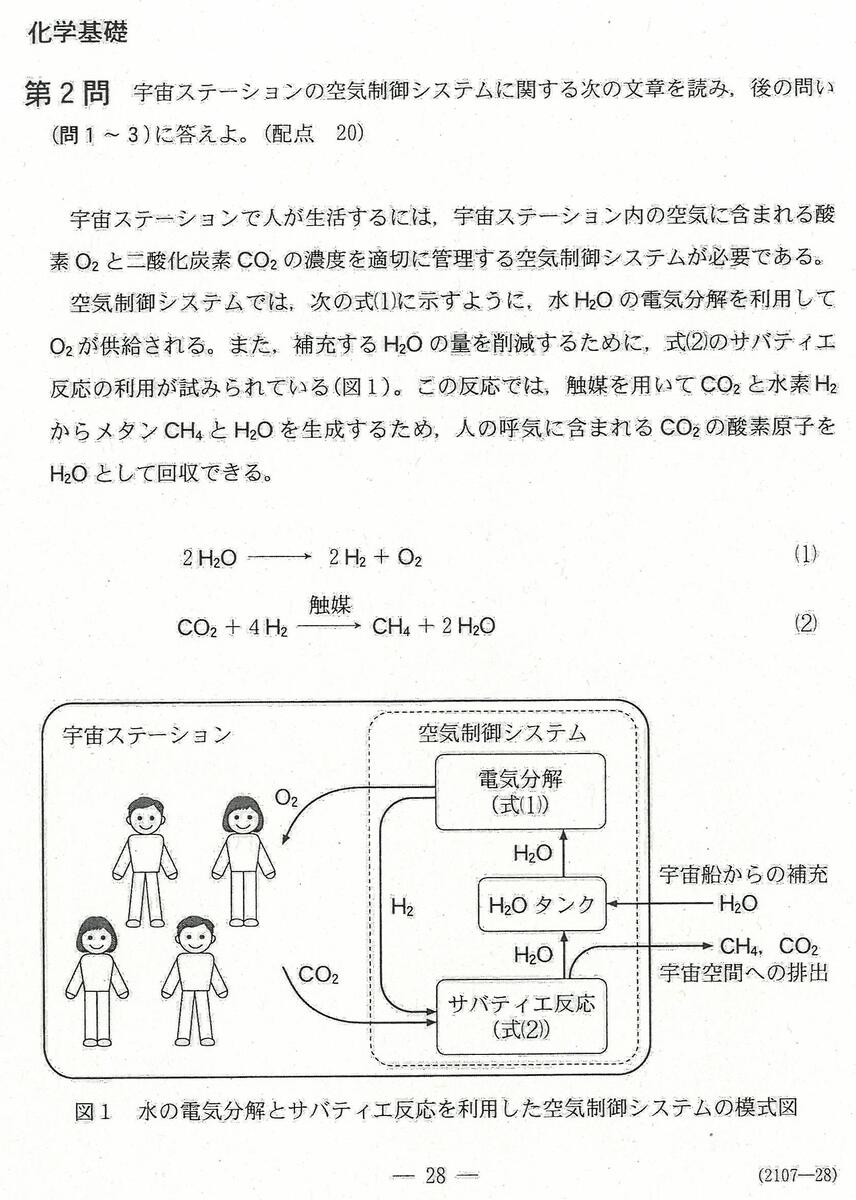
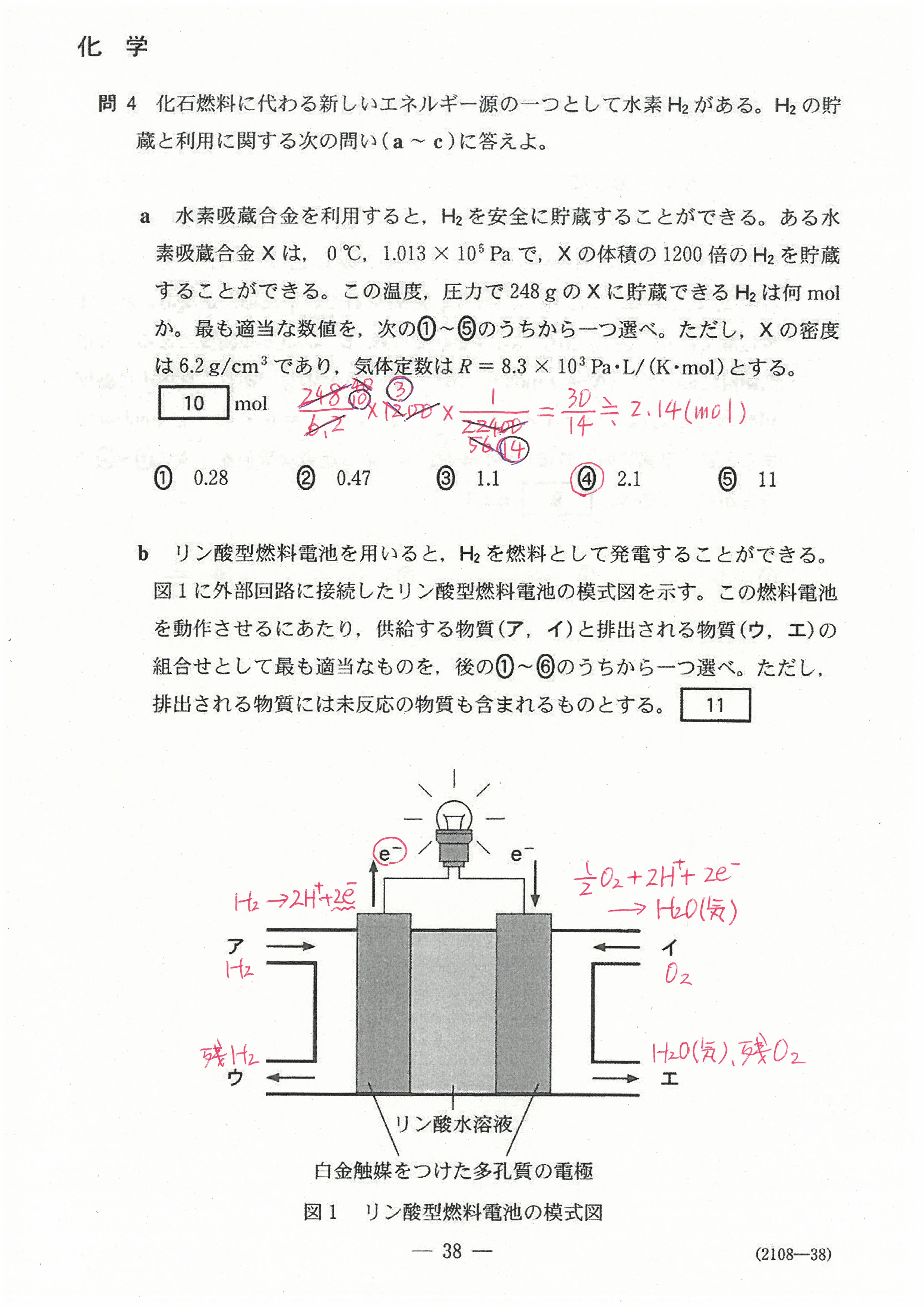
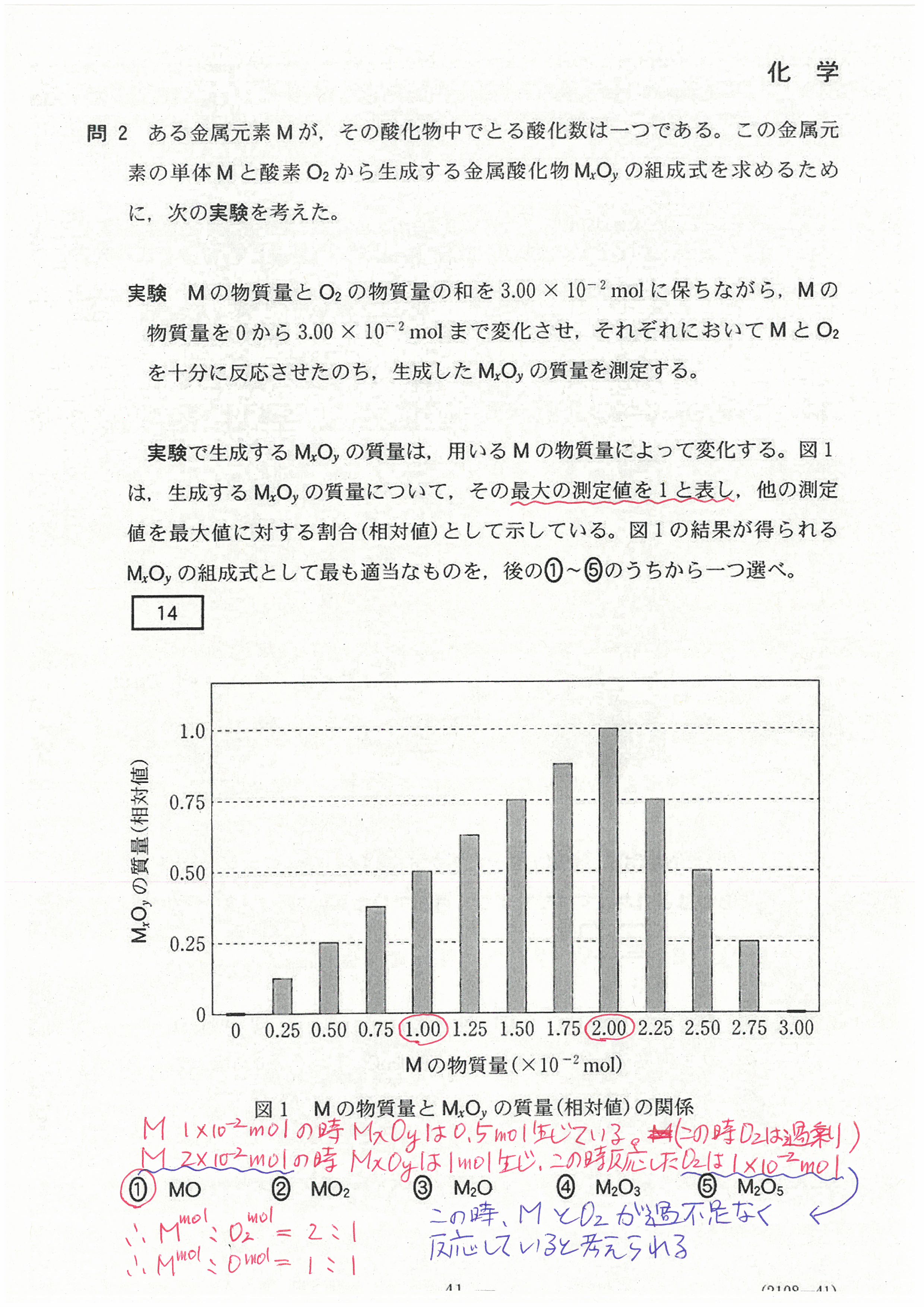
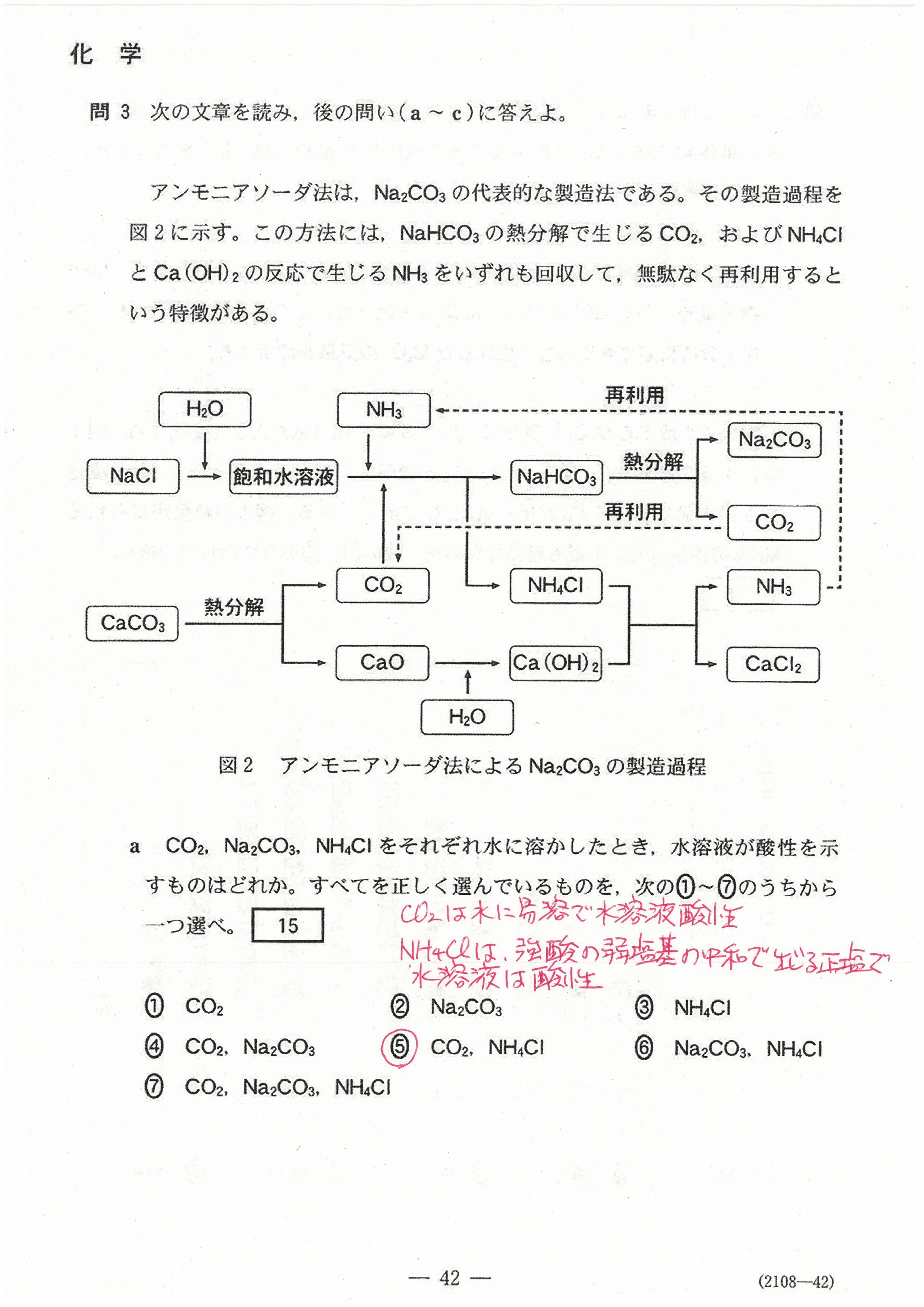
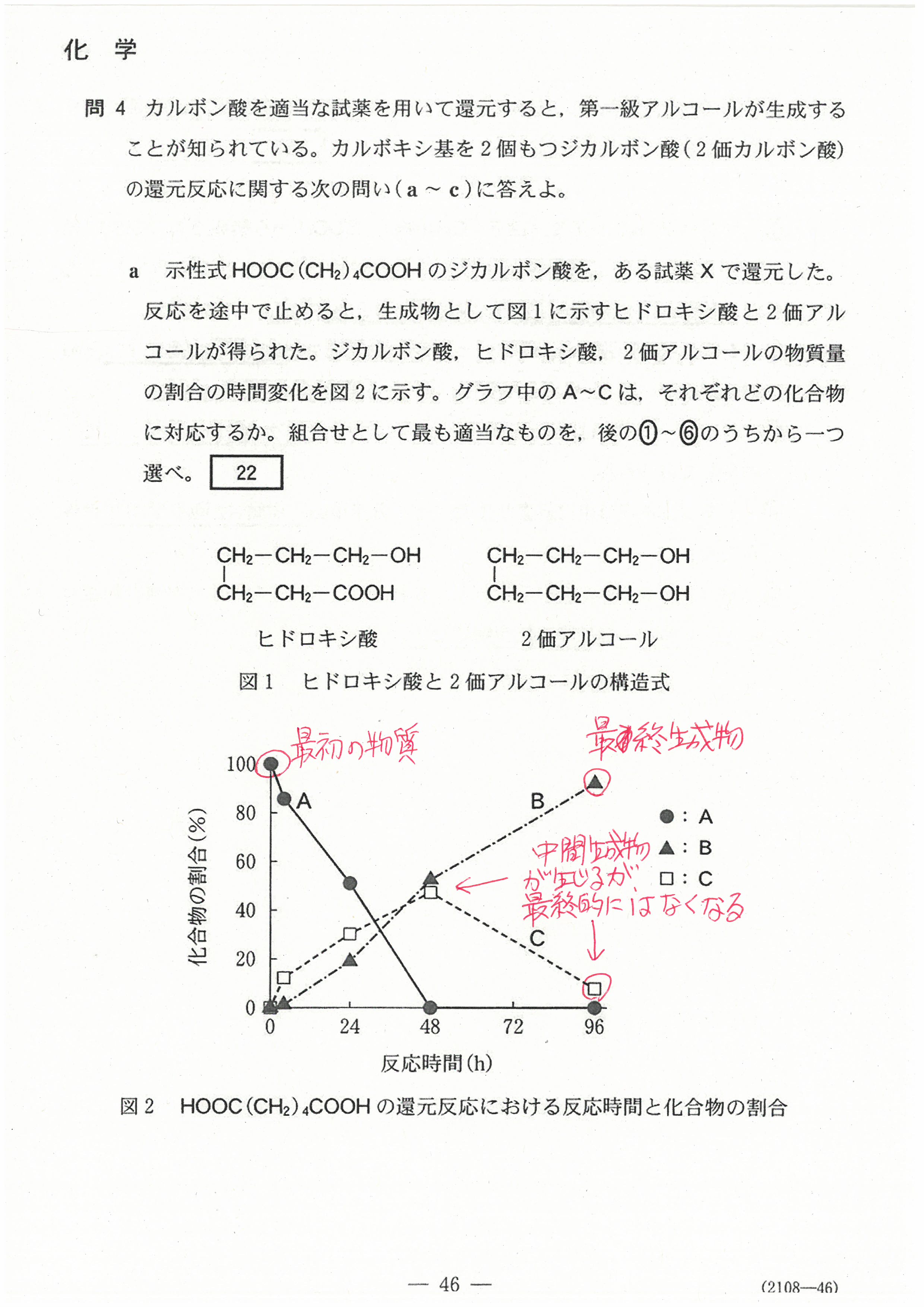
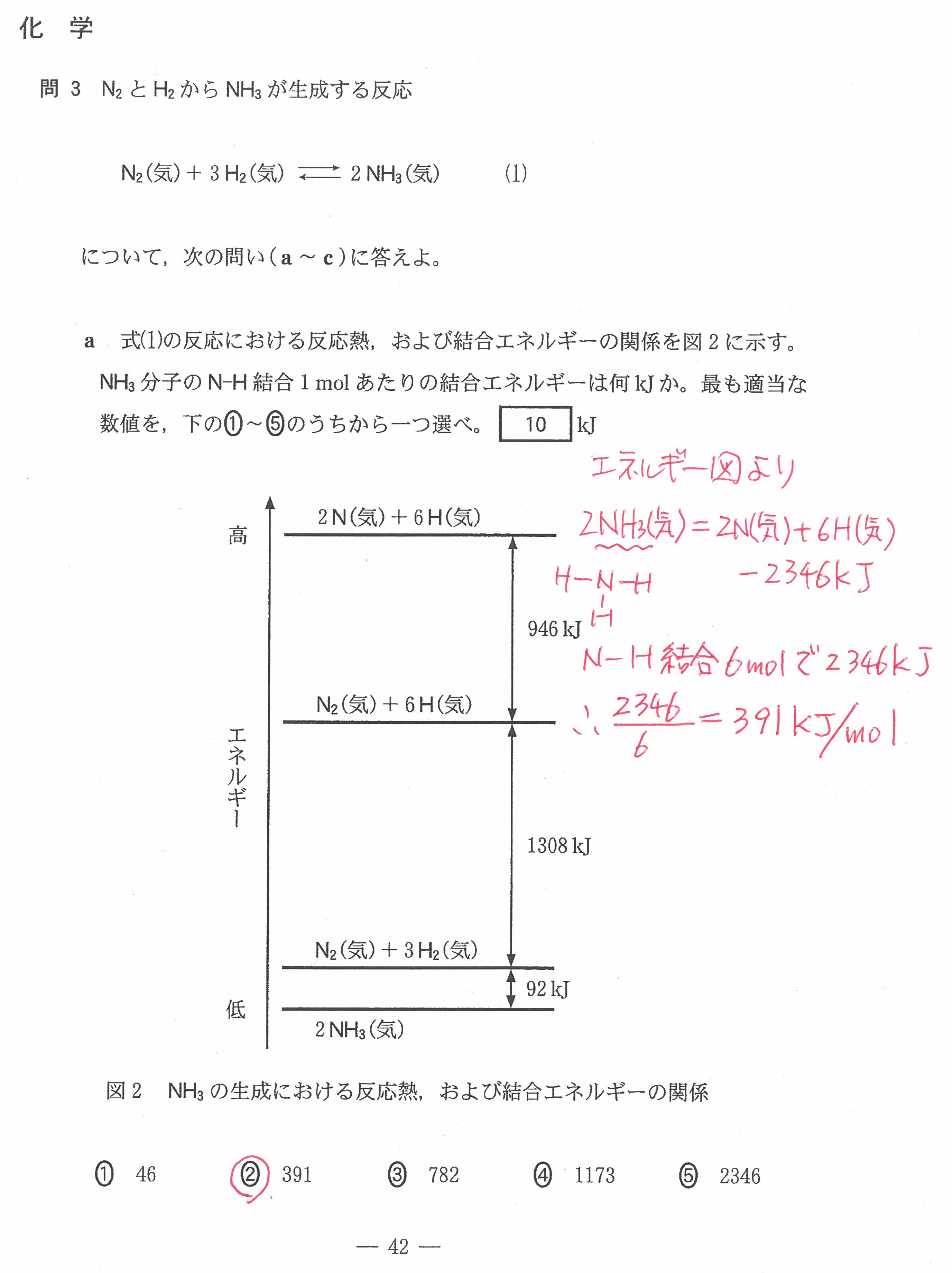
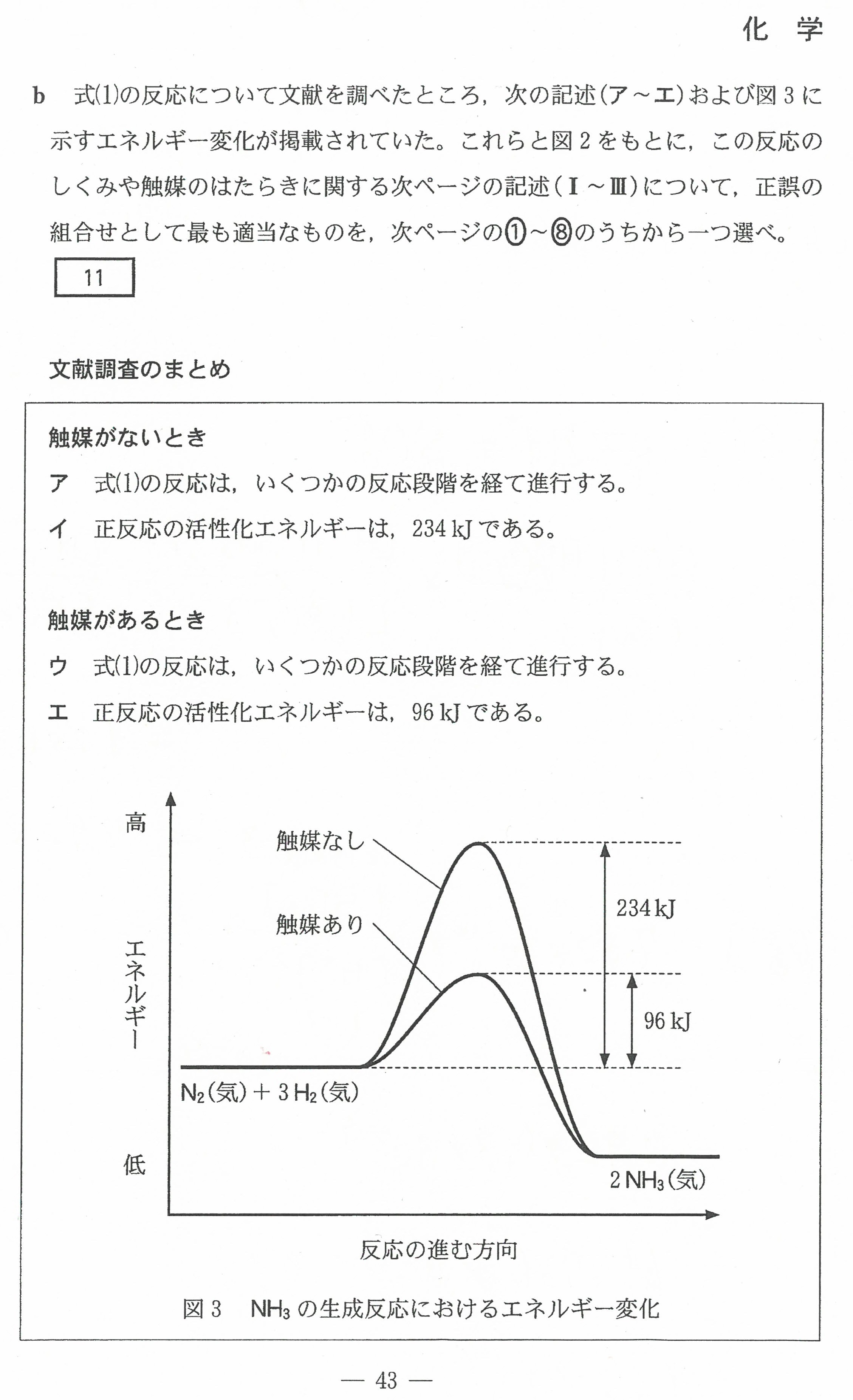
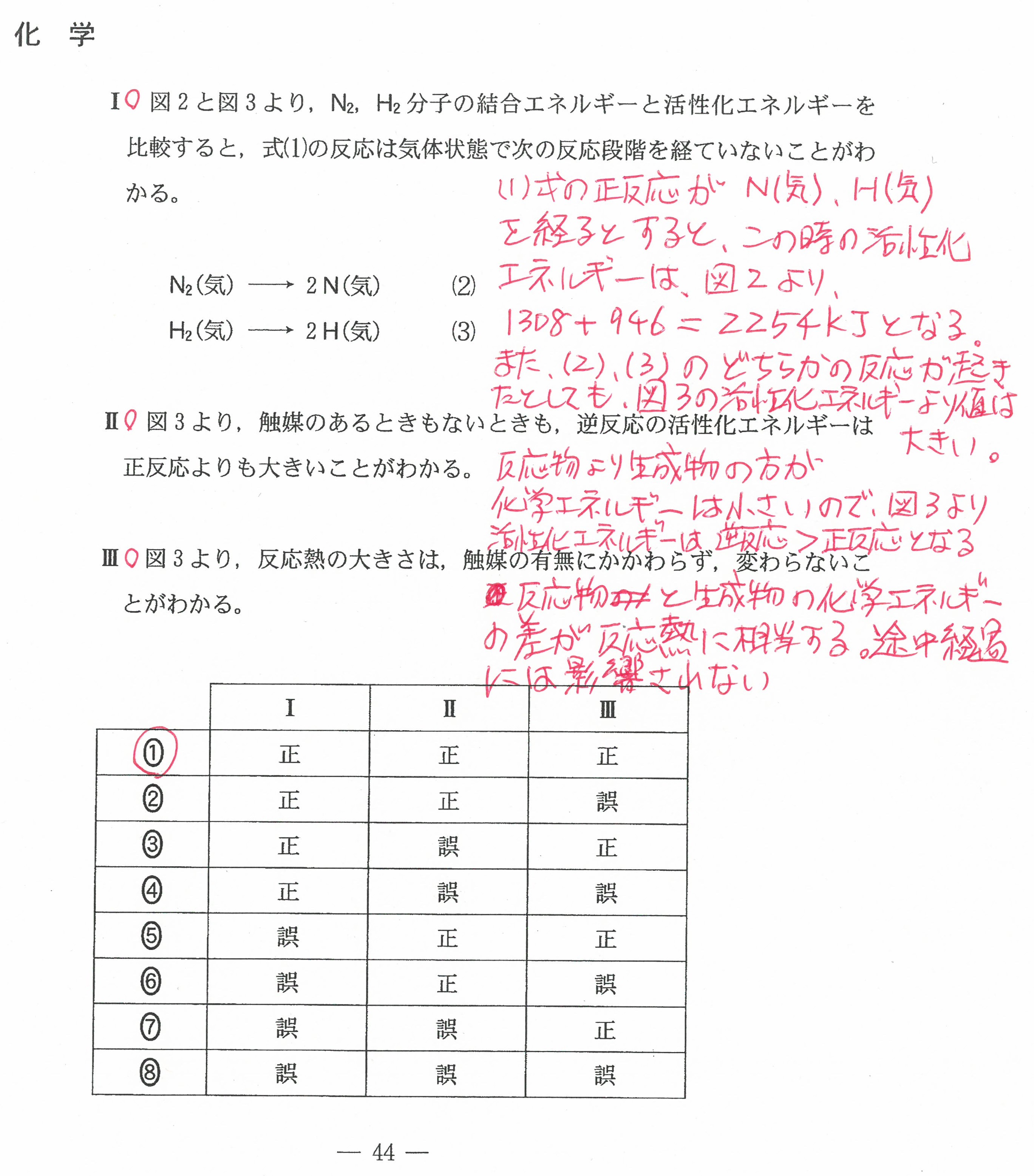
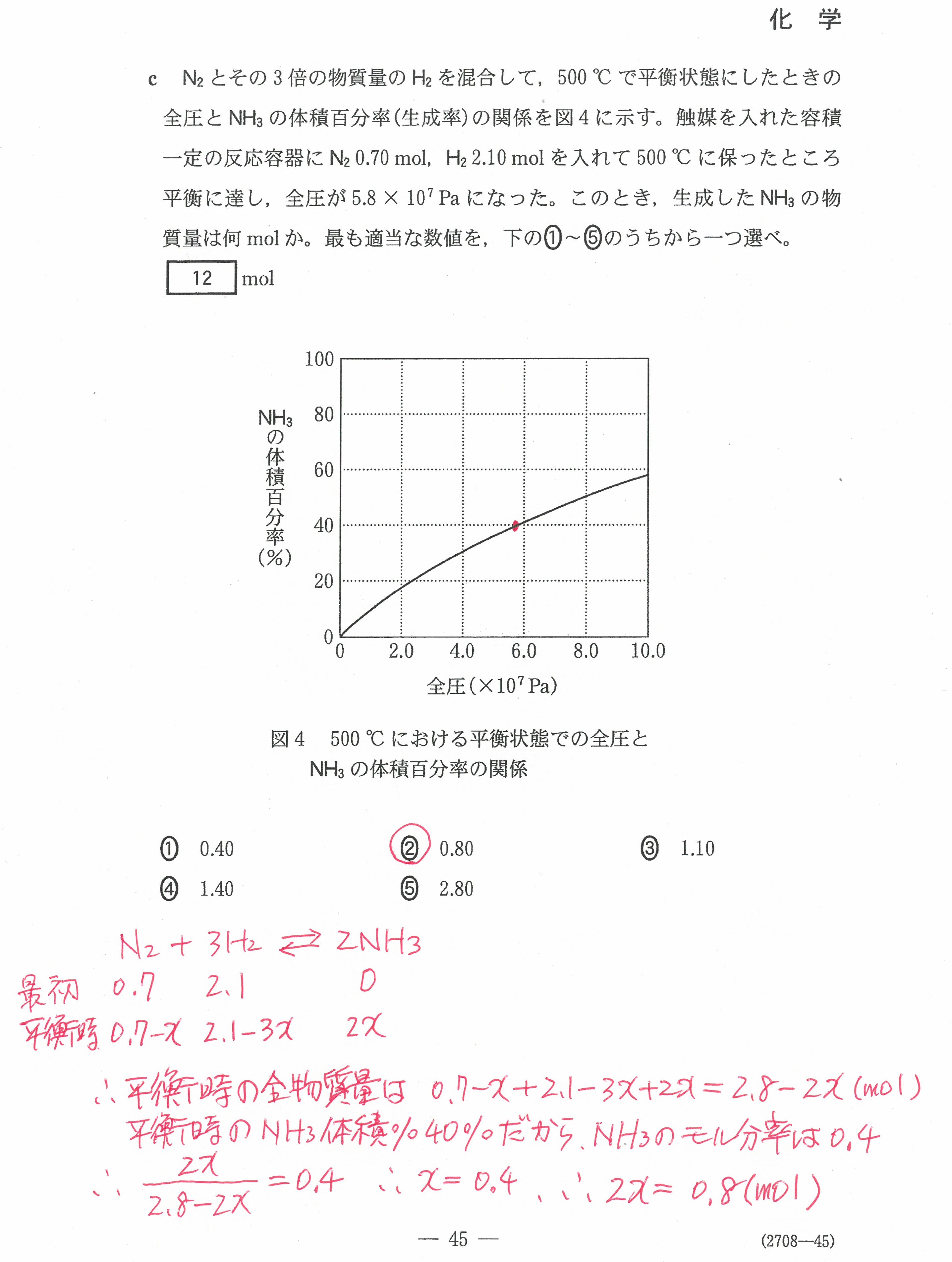
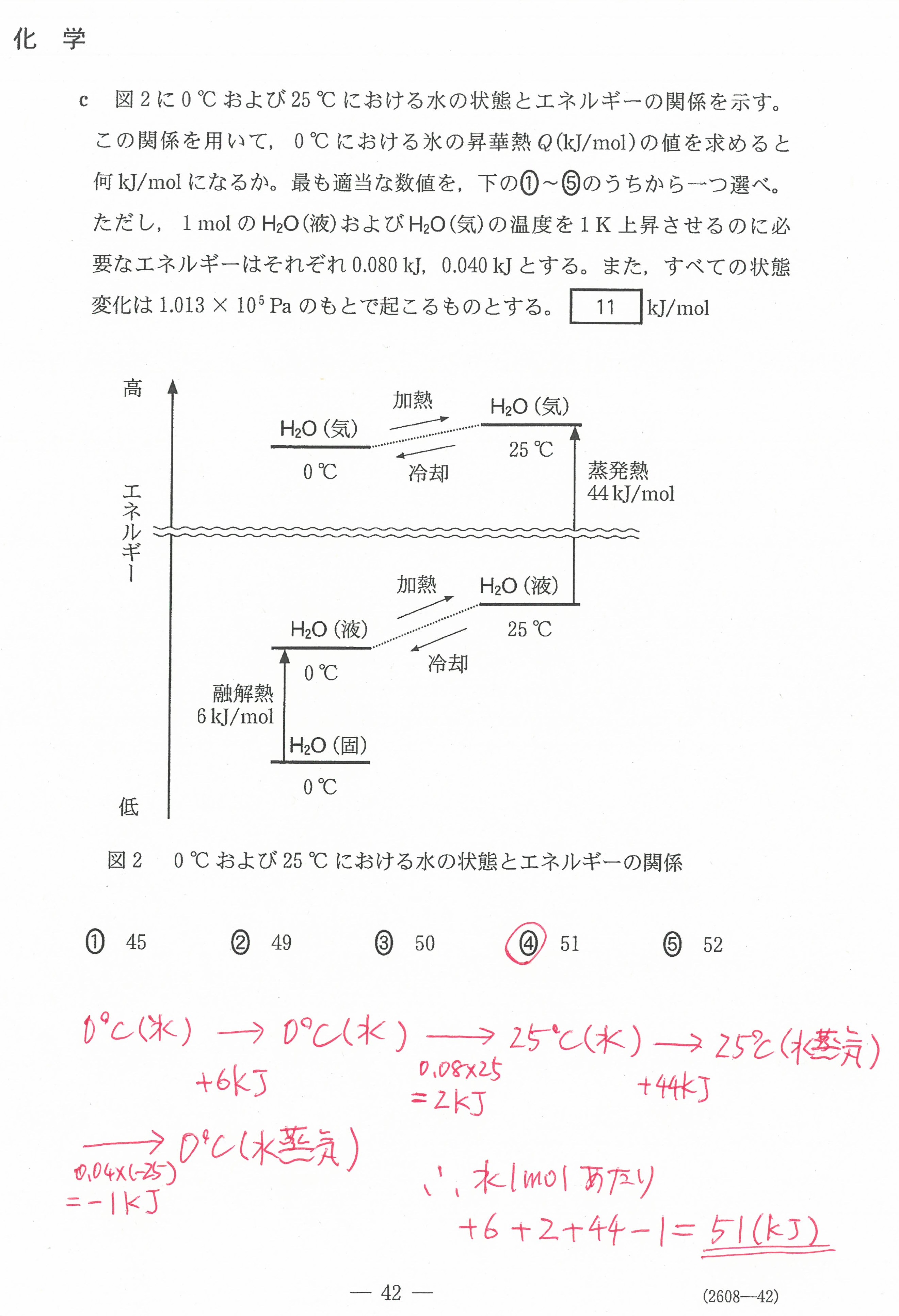
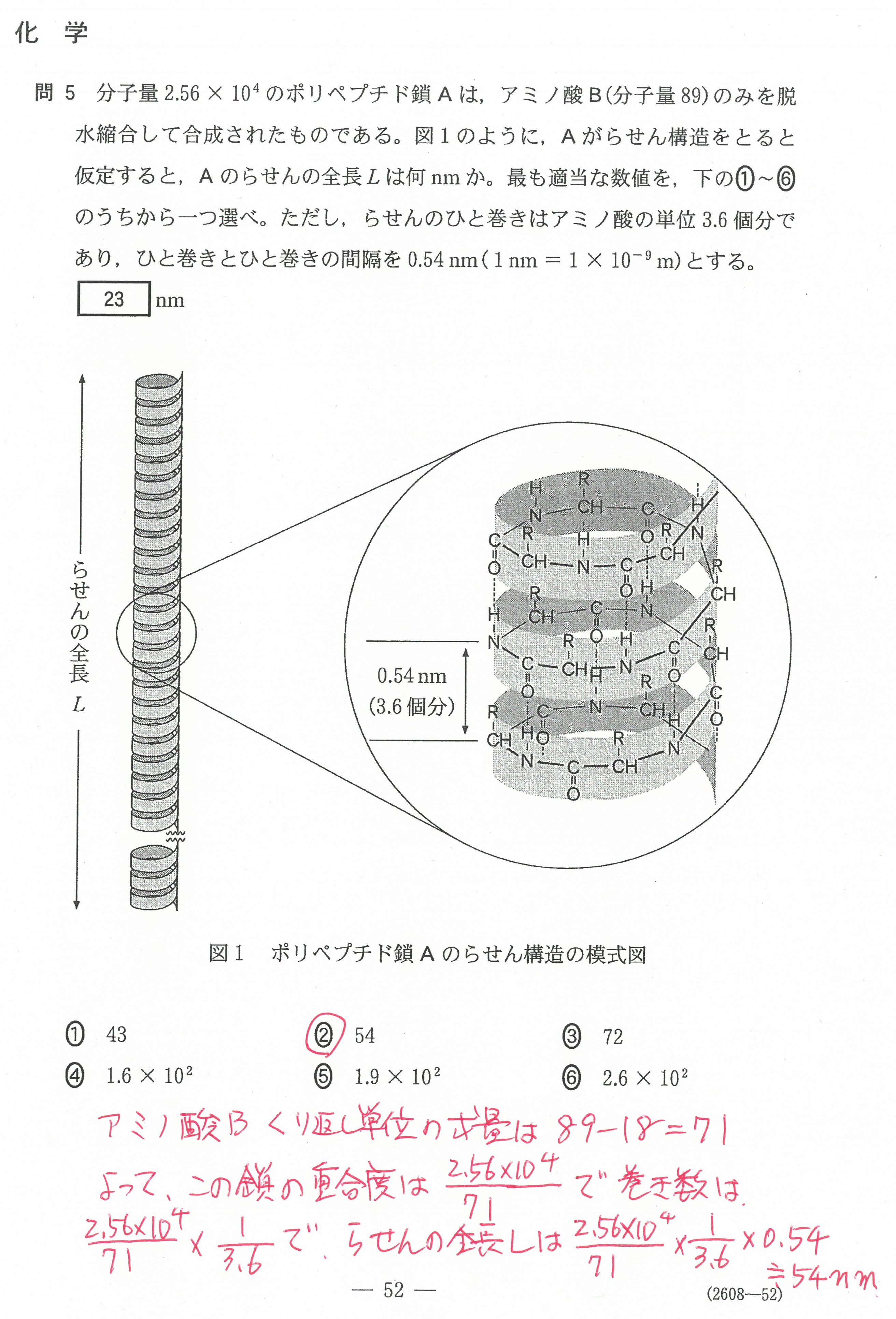
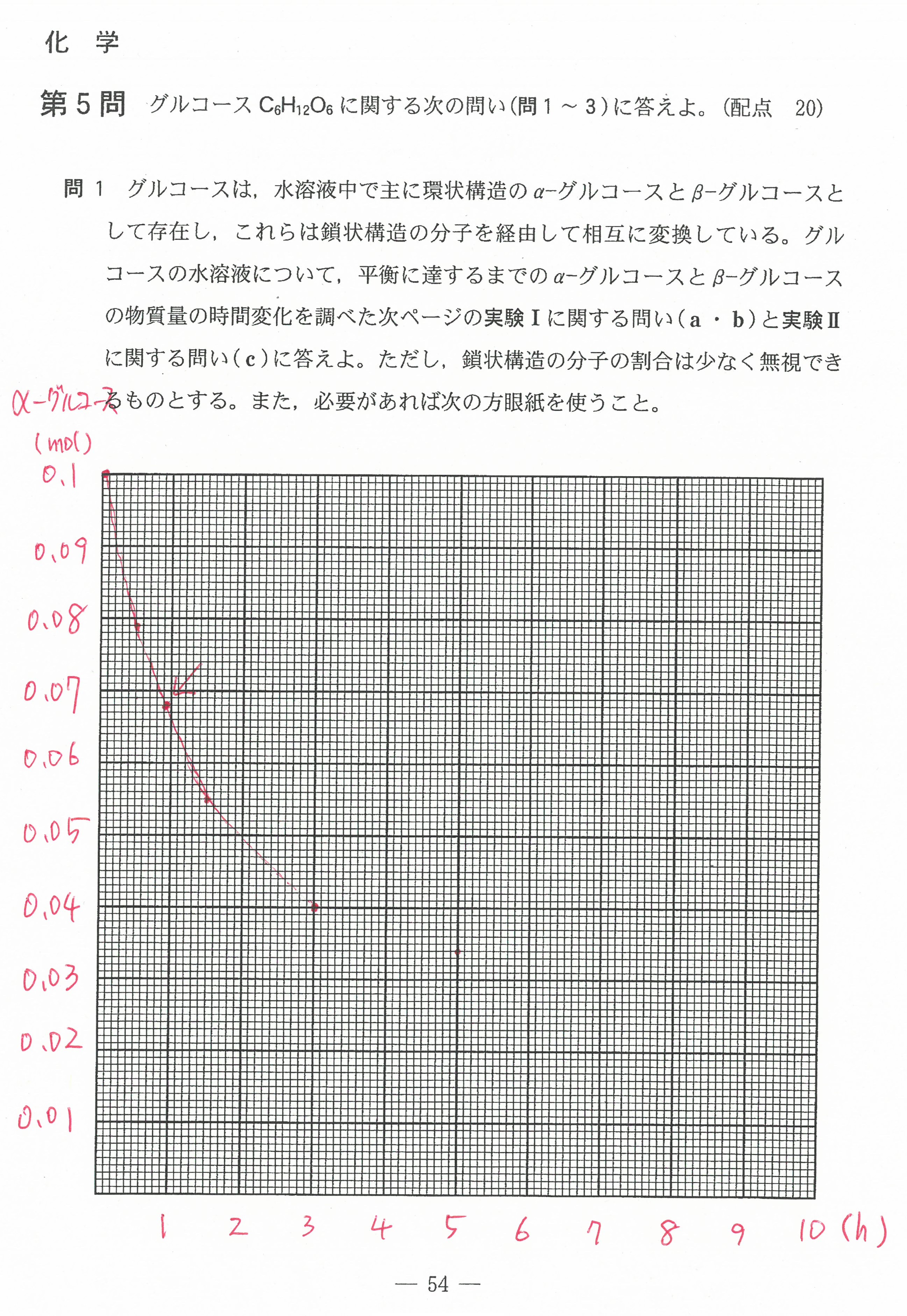
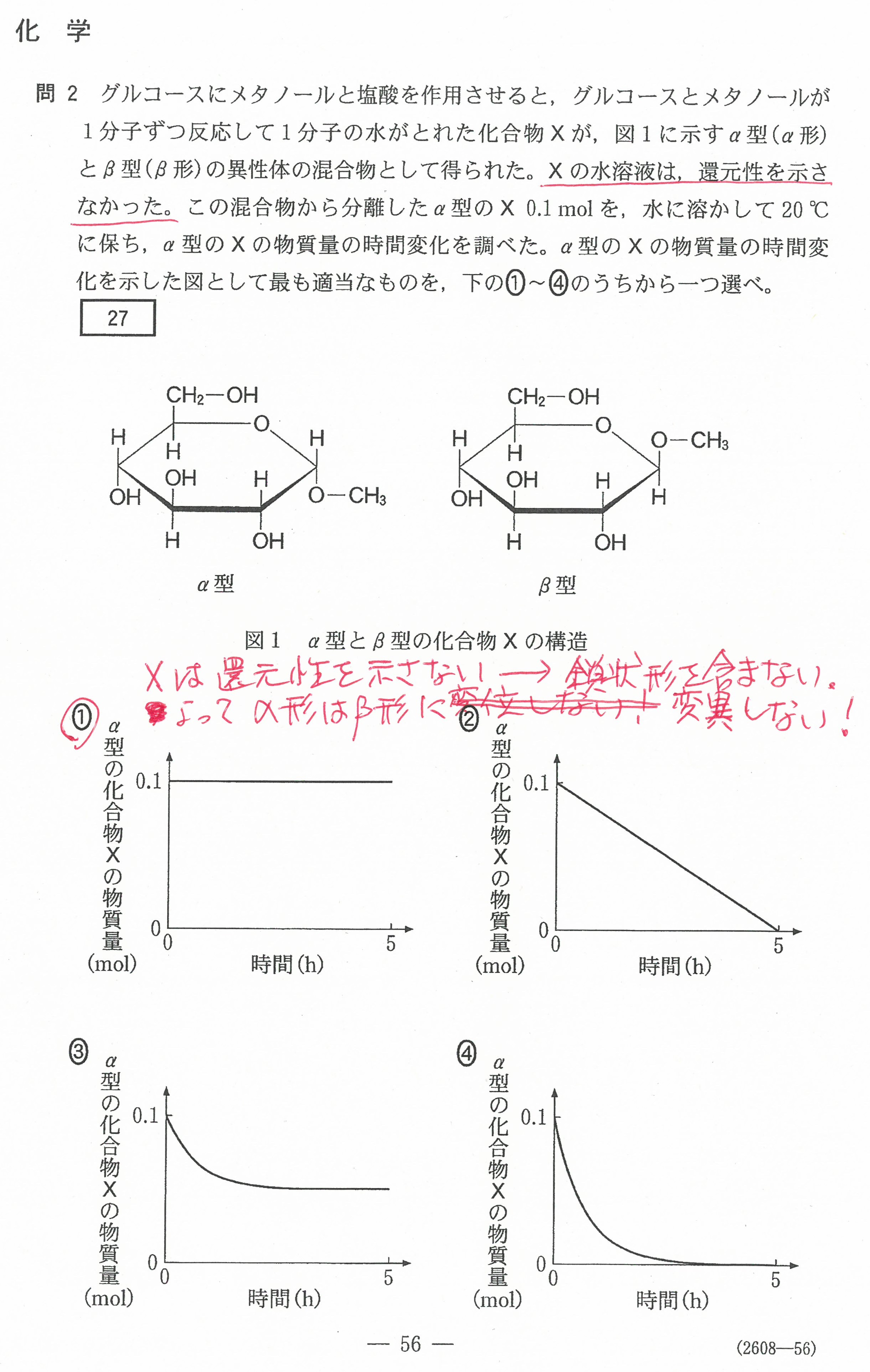
入試問題・模試問題 解説等
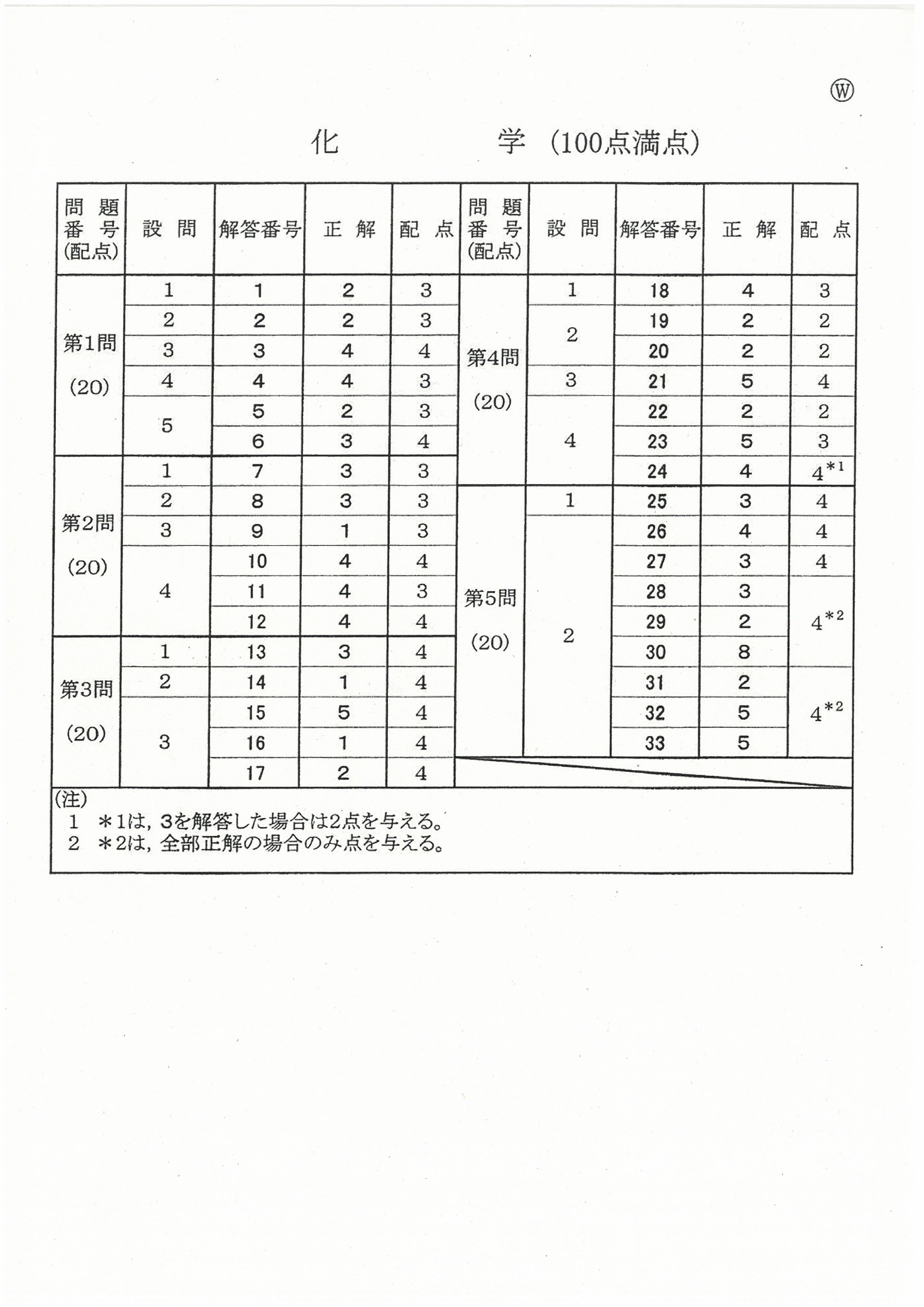
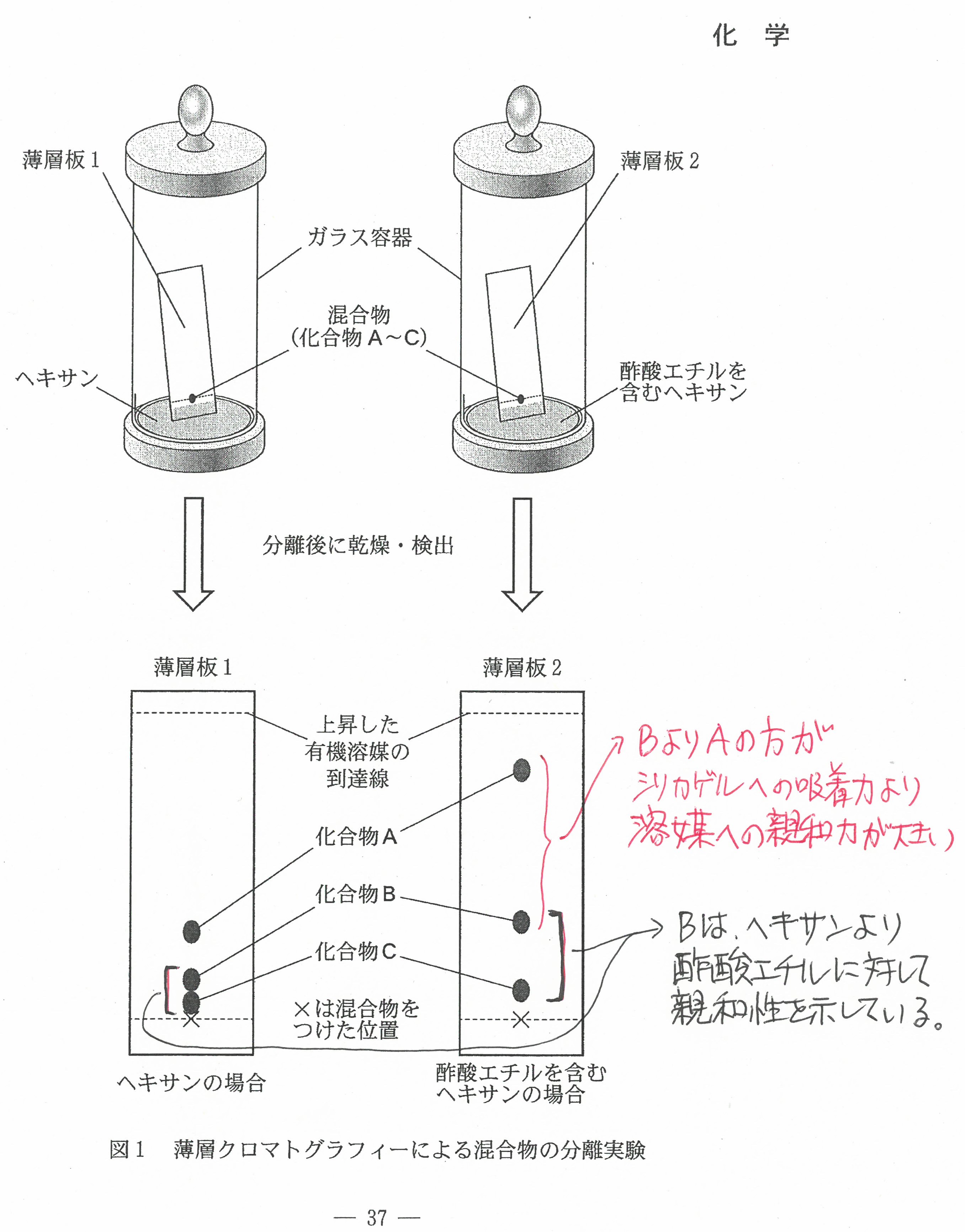
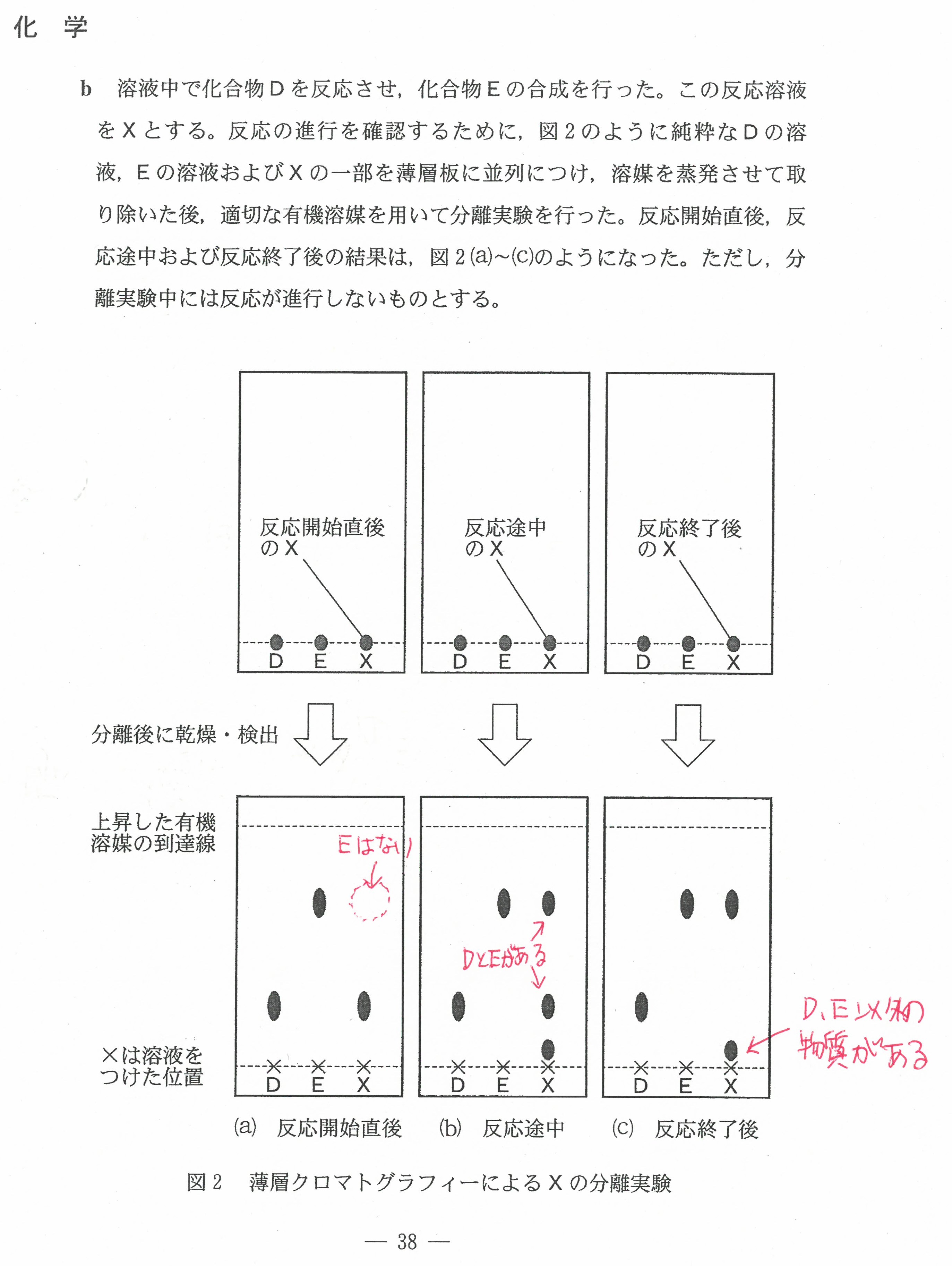
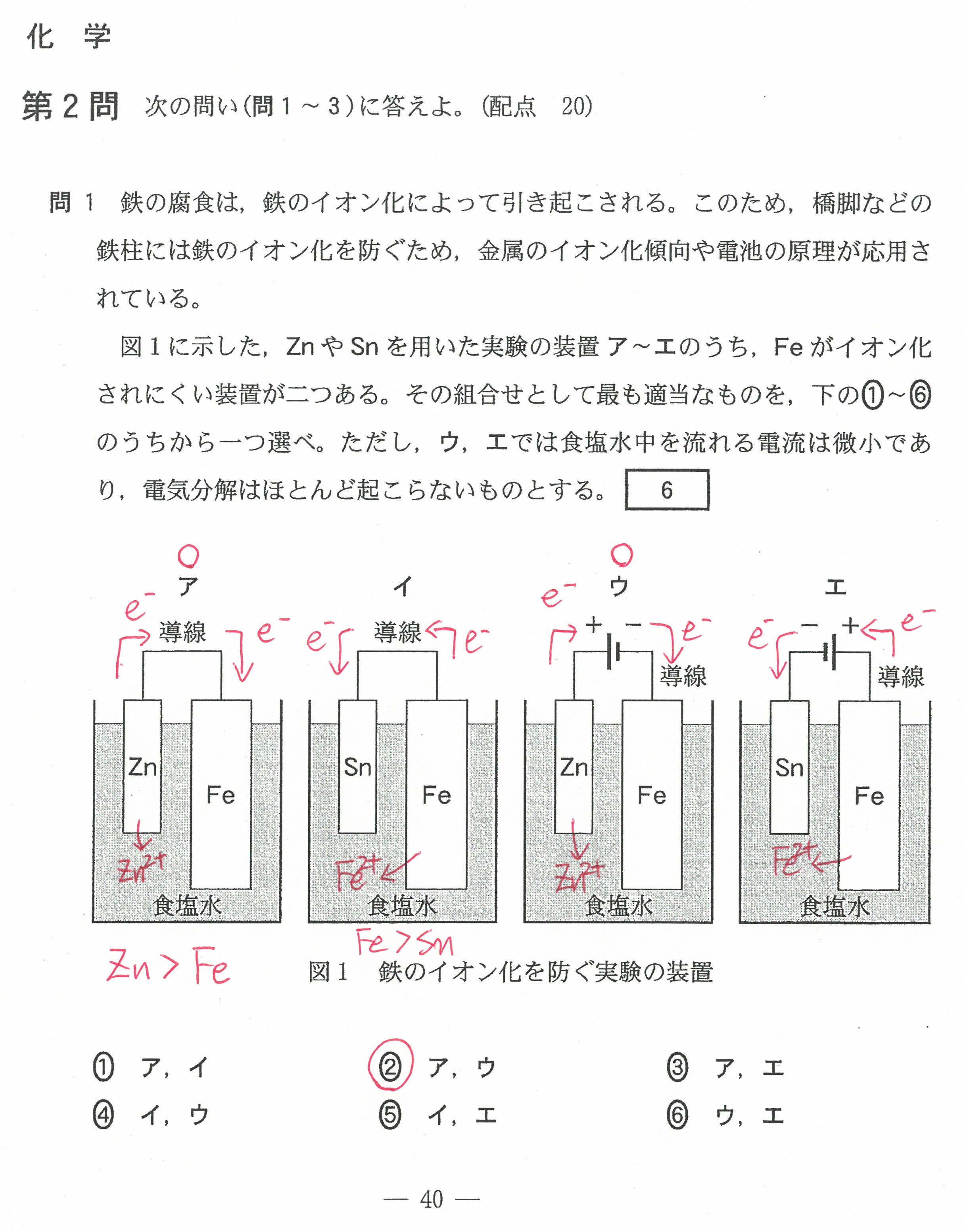
R6年度入学共通テスト(化学)解答解説
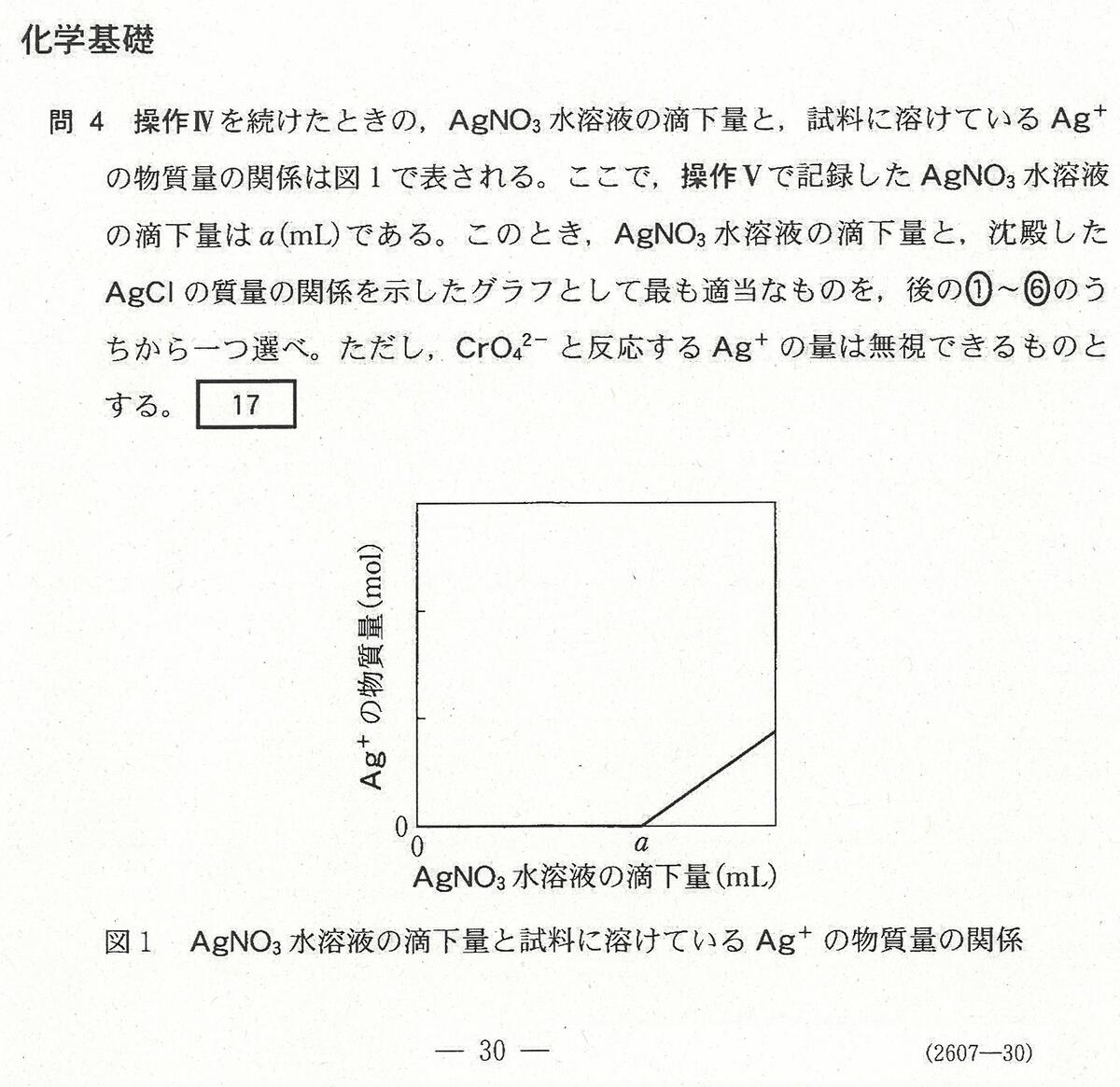
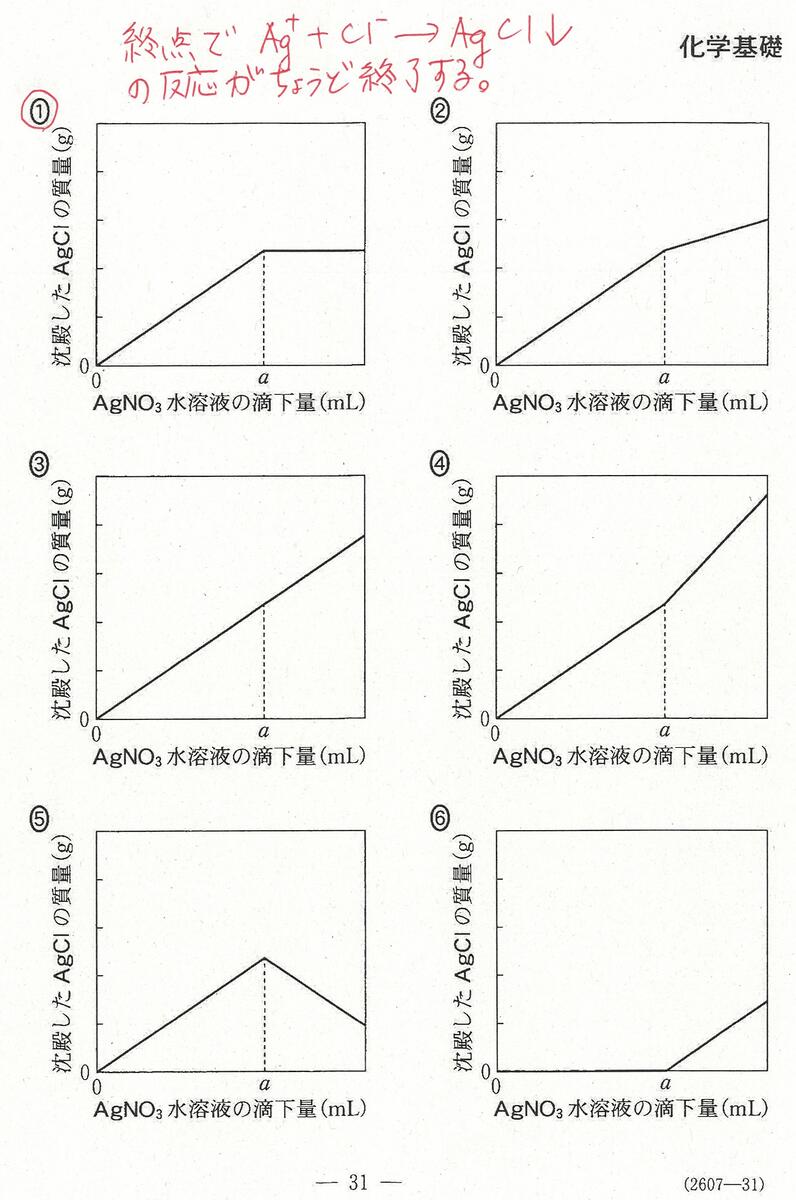
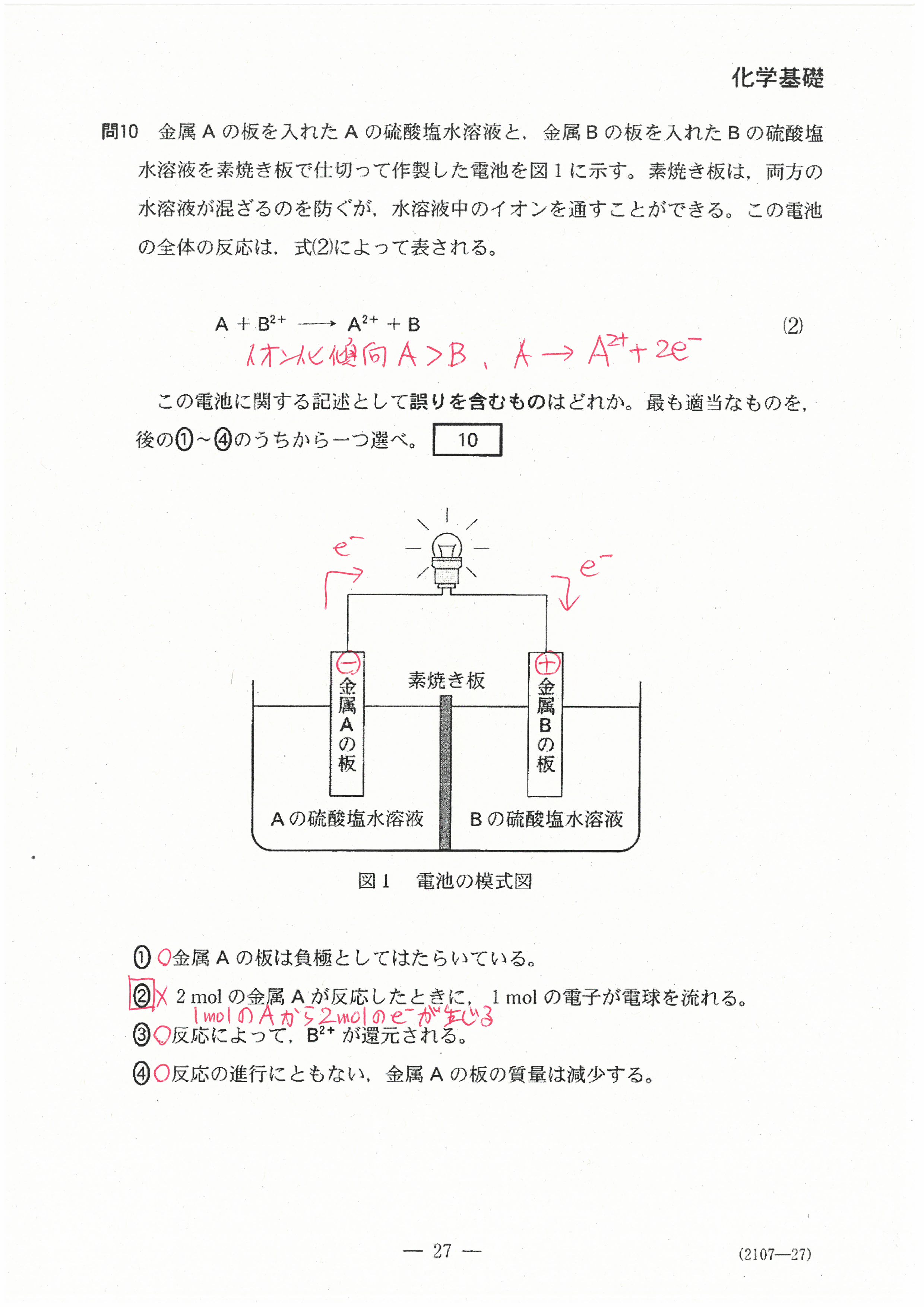
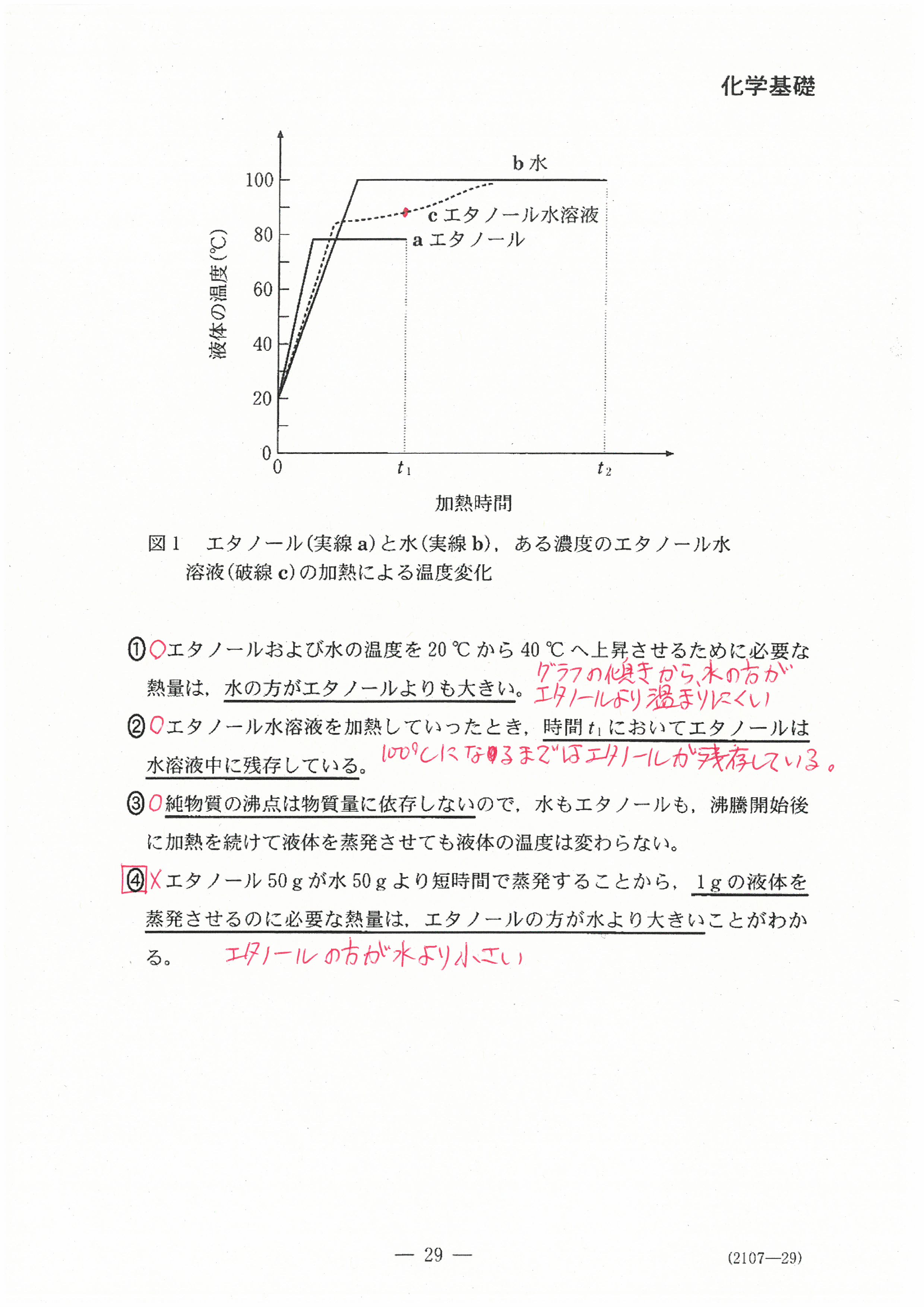
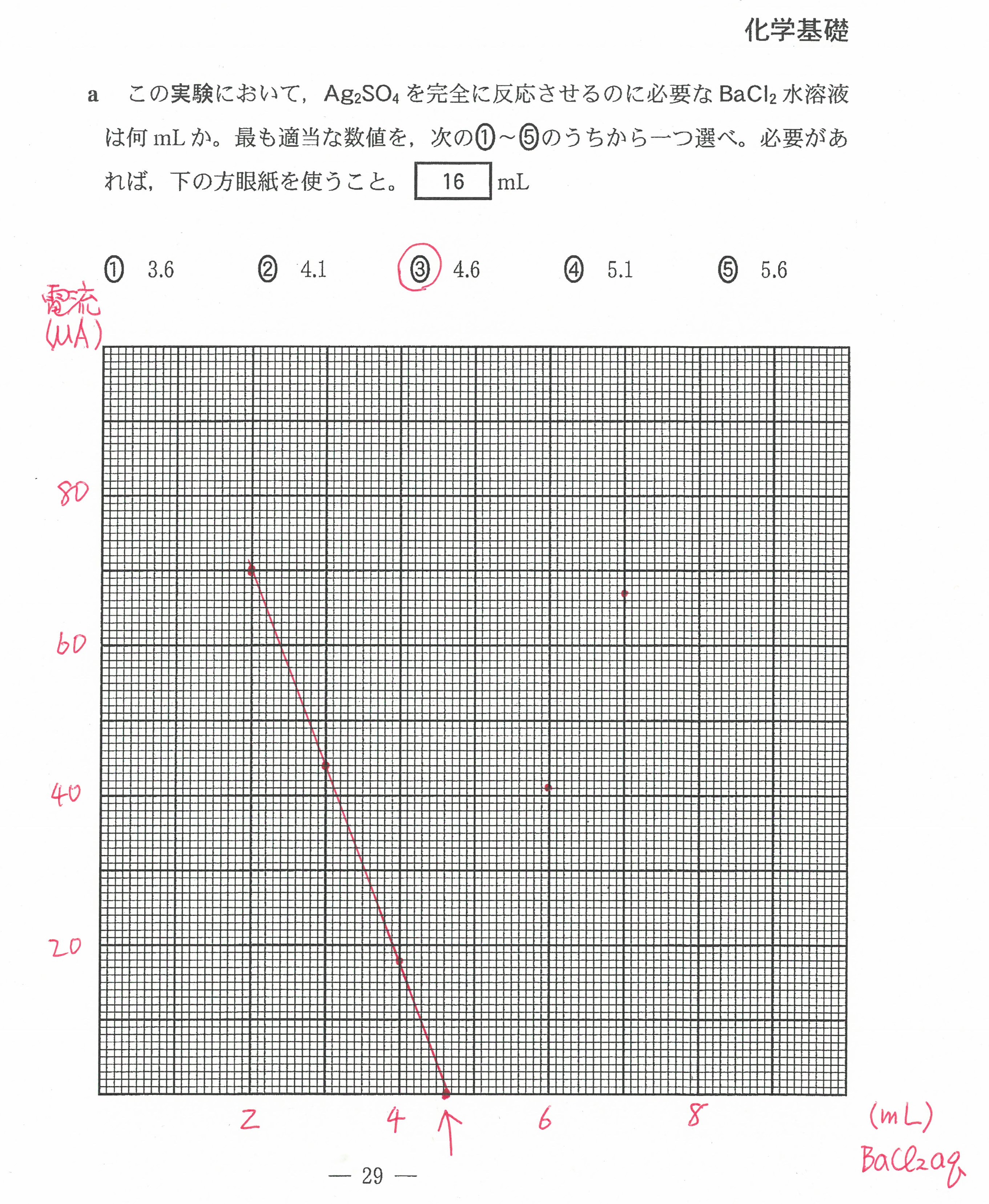
R6年度入学共通テスト(化学基礎)解答解説
R5年度共通テスト(化学、化学基礎)振り返り
今回の共通テストの内容についてです。
<化学基礎>
・最後の沈殿滴定の問題には時間がかかる。(思考問題)
「化学」で扱う内容なので、「化学」を勉強した生徒が有利ではあったと思う。
もちろん、この内容を知らなくても解けるようには考えられていた。
・その他の問題は、シンプルで解きやすく、分量も多すぎない。
<化学>
・問題の量が多い! 共通テストになってからこの傾向は変わっていない。
・難問ではないにしても、標準以上の難易度の問題が多く出されていた。
また、即答できるような簡単な問題も出されていた。
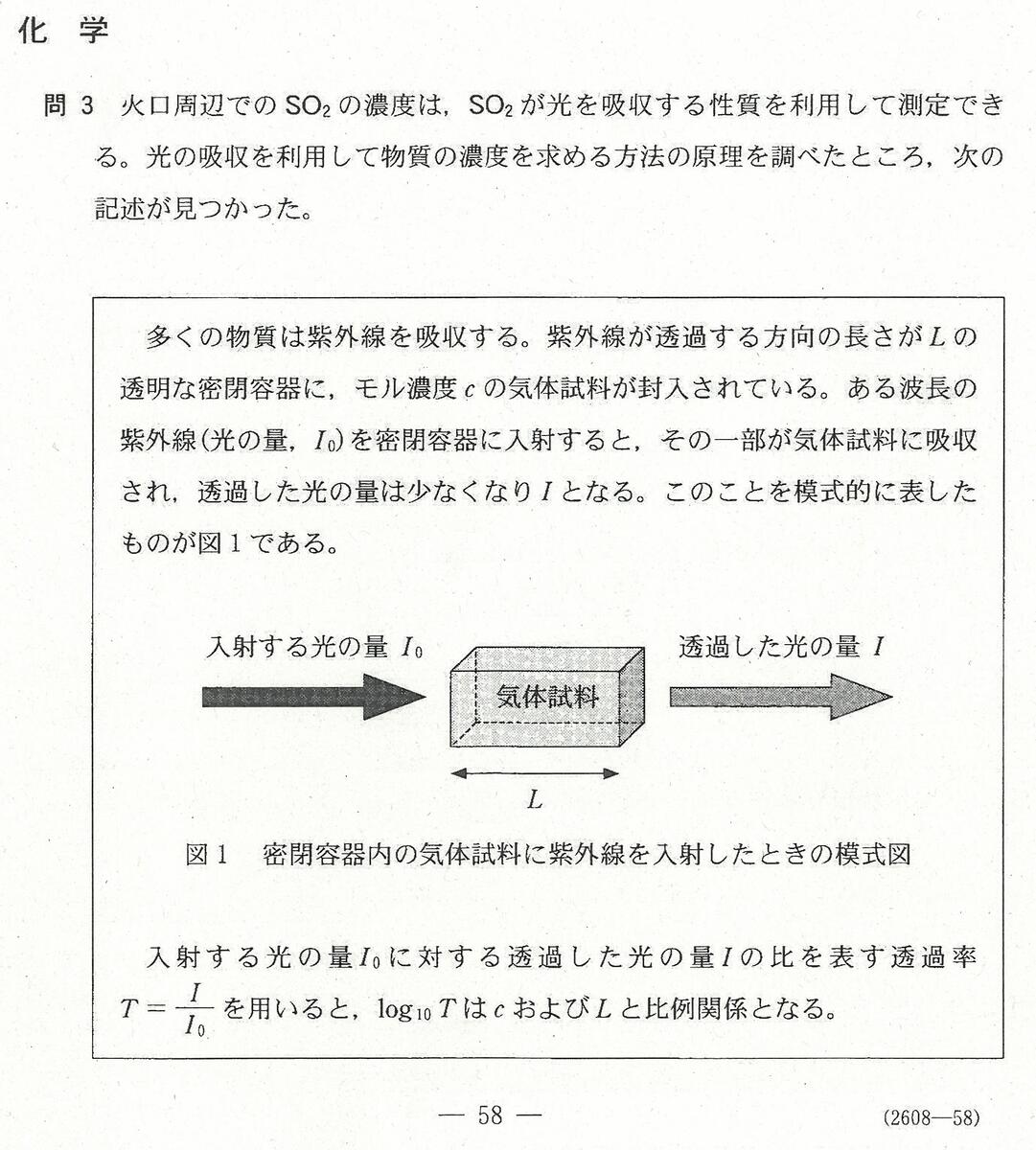
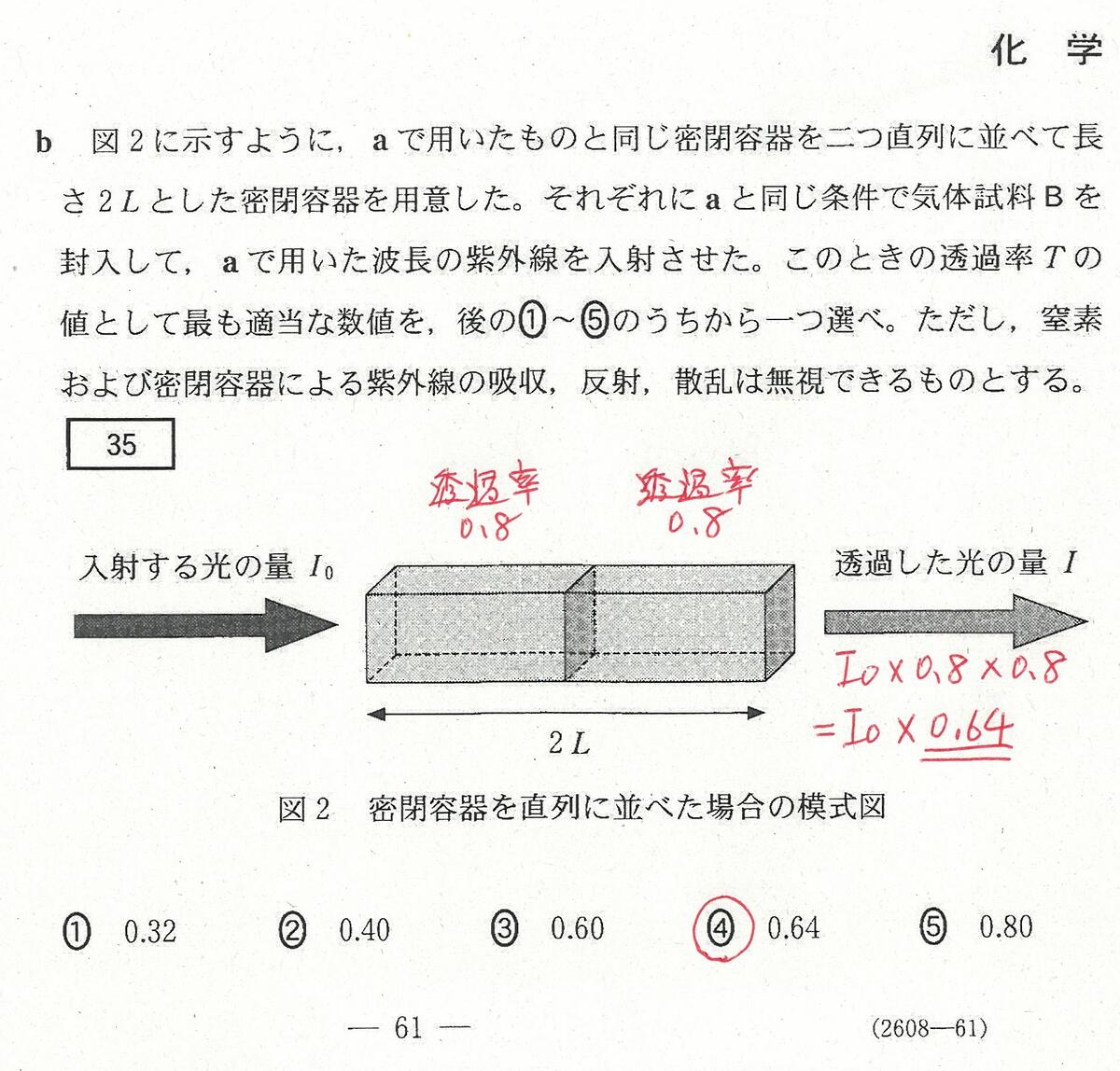
・最後のSO2中の光の透過率の問題が「思考問題」だったが、ポイントを見つければ時間はかからない。
さて、このような問題に対しての対策です。
まず、現状の多くの模擬試験が、本番の模擬試験になっていないように感じているんです。
本番の問題とかなりかけ離れてしまっているのではないでしょうか。
センター試験の頃の状況と比較して、今回までの3回の共通テスト本番で、全て同じように感じています。
その原因の一つと思われるのは、「思考問題」に対する対応のような気がしています。
模擬試験や問題集の中の「思考問題」は、内容に凝り過ぎていて、難し過ぎるもの、時間がかかり過ぎるものが沢山載せられていると感じます。
各社とも、「思考問題」についての練習問題作成に気張り過ぎているのではないでしょうか?
このため、受験生も、教える側も、「思考問題」の方に気が向きがちですし、
本番の「思考問題」と準備していた対策がかみ合っていない、ということが起きているような気がしています。
これまでの受験勉強は、
「本番で、いかに正確に早くアウトプットしていくか」
というトレーニングを積んできた面があると思います。
そして、この練習を沢山積むことで高得点に近づいて行けたと思います。
しかし、この勉強法を積むほど、
「じっくりと思考できるようになる訳ではない!」
ということになっちゃうんですね。
(もちろん、従来通りのこの勉強法も依然として必要ではありますが!)
共通テストで一部問題のスタイルが変更されたのは、
本来の、「思考する勉強」を受験生にさせるのが目標になっているのではないでしょうか?
これまで、あまり考えずにアウトプットしてきた習慣を改め、
すごく手間も時間もかかるんですが、
「まずは基本を大切にして、出来るだけ理由を考えながら勉強する、問題を解いていく」
「常にこの基本姿勢で勉強することを心がけよう!」
というのが自分からの提案です。
※ 例えば、「H2O2中のOの酸化数は-1」
と教わりますが、なぜ?
R5年度入学共通テスト(化学)解答解説
R5年度入学共通テスト(化学基礎)解答解説
来年以降、化学受験を考えている人たちへ
今回の共通テストの解答と解説を載せましたが、どうしてこう考えるのか? といった解説があった方がいいですね。
このように出来たら、またここにアップしたいと思います。
さて、共通テストも2回目が終わりました。(第2日程の分もありましたね)
今までのセンター試験と問題がどう変わってきたのか、
これからの勉強方法はどうすればいいのか、について書いてみたいと思います。

化学、化学基礎についてですが、
これまでのセンター試験では、たくさんの過去問やそれに類する問題を出来るだけ多く解く。
素早く正確に解けるようにする。
この勉強法で高得点、満点を狙えました。
共通テストでもこの勉強方法で間違ってはいないと思います。
でも、共通テストが始まる前に公開された「試行問題」の中にあったような「思考させる問題」が本番でもやはり多めに出題されています。
この「思考させる問題」は、予想していたよりそれほど難しい内容ではないものの、こういう問題には試験本番の時初めて出会うということになるでしょう。
見たこともない問題に出会うだけで焦りますし、その分時間のロスになったりします。
この手の新しい問題に対して、どう勉強していけばいいのでしょうか?
まずは、今までの勉強法を見直しましょう!
今までは、「問題を沢山解いて慣れればいい。沢山解くほど慣れていく」
というスタンスで勉強してきませんでしたか?
確かに、同様の問題を沢山解くことによって、素早く正解が出せるようになってきたでしょう?
しかし、冷静に考えてみると・・・
慣れてきたということは、「今までのやり方を間違えずに早く出来るようになった」ということなんですね・・・!
「深く考えるようになった」というのではちょっとないのです。
もちろん、慣れて余裕が出来る分、他のことを考えられるようになるとかはありますが。
さあ、どうすればいいのでしょうか?
いつも、
「常に原理等を考えながら解く! そして、考えることに慣れよう!」
というのが自分からの提案です。
中和滴定の公式の意味も考えておく、とか、酸化数の原理は何だろうとか。
もう一つ、感じたことを書いておきます。
現行の共通テスト向けの問題集、そして模擬試験、予想問題集についてです。
「思考させる問題」について対策がされていて色んな問題が出題されていますが、
各社とも気張ってしまっていて、凝った問題になり過ぎているのではないかと強く感じています!
もっと基本的な思考問題を沢山解いていった方がいいのではないでしょうか?
「思考問題」対策に気を配りすぎずに、常に考えながら問題を読み解くクセをつけた方がいいと感じています。
R4年度入学共通テスト(化学基礎)解答解説
R4年度入学共通テスト(化学)解答解説
第1問の問3の解説を訂正しました!
最初の解説が間違っていたことをお詫びします。
申し訳ありませんでした!
桁が異なる単位同士の計算
これも新しいタイプの出題ですが、内容は難しくありません。
ここでは、桁が異なる単位の計算処理について書いてみたいと思います。
この問題では、雨水中の水素イオンH+の物質量(mol)を求めて、これと反応するCaCO3の物質量(mol)そして質量(kg)を計算できそうです。
では、まずH+の物質量(mol)を求めましょう。
H+(mol)=[H+](mol/L)× V(L)・・・①
上式のVは、降った雨水の体積(L)です。
そして雨水の体積Vは、雨が降った面の面積Sと降った雨の厚み(深さ)hから求められます。
体積V=面積S × 深さh・・・②
問題文中で、面積Sの単位は(km2)、深さhの単位は(mm)で与えられています。
体積Vを求める時に単位を揃えて計算しなければならないのはもちろんですが、最終的に体積Vはどの単位で表せばいいでしょうか?
(km3)?、(m3)?、(cm3)?、(mm3)?
ここで、(L)と(cm3)の換算、(L)と(m3)の換算がしばしば必要になるので、この換算の方法を覚えておいて下さい!
ということで、体積Vを(cm3)か(m3)で求めて、さらに(L)に換算することにしましょう。
では、これら2種の換算をこの問題の値で実際にやってみたいと思います。
【 体積を(cm3)で求めて(L)に換算 】
1.0(km2)=(1000 × 100cm)2=1010(cm2)
5(mm)=0.5(cm)
∴V=S × h=1010(cm2)× 0.5(cm)=5 × 109(cm3)
ここで、
1000(cm3)=103(cm3)=1(L)
よって、
V=5 × 109/103 = 5 × 106(L)
【 体積を(m3)で求めて(L)に換算 】
1.0(km2)=(1000 m)2=106(m2)
5(mm)=5 × 10-3(m)
∴V=S × h=106(m2)× 5 × 10-3(m)=5 × 103(m3)
ここで、
1(m3)=1000(L)=103(L)
をぜひ覚えましょう!
<1(m3)=(100cm)3=106(cm3)=1000(L)>
よって、
V=5 × 103 × 103 = 5 × 106(L)
どうでしょうか?
要は計算慣れしておけば難しくはないことが分かったのではないでしょうか?
では、式①のところに戻って、この問題を最後まで解いてみましょう。
pH=4より、
[H+]=10-4(mol/L)です。
∴ H+(mol)=[H+](mol/L)× V(L)
= 10-4(mol/L)× 5 × 106(L)
= 5 × 102(mol)
CaCO3 + 2H+ → Ca2+ + CO2 + H2O
より、H+と反応するCaCO3は、
5 × 102(mol) × 1/2 = 2.5 × 102(mol)
CaCO3=100(g/mol)より、
反応して溶け出すCaCO3は、
100(g/mol)× 2.5 × 102(mol)=2.5 × 104(g)
2.5 × 104(g) ⇒ 2.5 × 104/103
= 25(kg) 答 1⃣②、2⃣⑤
化学反応式の係数と量関係
化学反応式を書いて、それを元にして反応物や生成物の量関係を考える・・・
この量関係の考え方について、お薦めの方法を書いてみたいと思います。
すぐに公式を使おうとせず、原理を考えるクセを!
これも新タイプの出題なんですが、ちょっと考えてみて下さい。
文の量は多いんですが、難しい内容ではありません。
公式を使って説明するなら、
Q=mcΔT 【Q(熱量)、m(質量)、c(比熱)、ΔT(温度差)】を使い、
この式を ΔT= Q/mc に変形して考えれば解けそうですね。
ですが、出来るだけ「考えながら解く」というスタンスで原始的にいってみましょう!
実験結果の「表1」を見て下さい。
塩酸を中和するために加えた水酸化ナトリウム溶液の量は、bはaの 1/2倍
ですから、
中和で生じた水の量も、bはaの 1/2倍
よって、
中和で生じた熱量も、 bはaの 1/2倍
一方、中和後の溶液の全体積について考えてみると、
a は 10 + 20=30cm3
b は 10 + 10=20cm3
中和後の溶液の全体積を比べると、
溶液の全体積は、 bはaの 2/3倍
です。
さて、溶液の温度上昇ですが、
発生した熱量が大きいほど温度上昇も大きくなります。
また、溶液の体積が大きくなるほど温度は上がりにくくなります。
よって、
溶液の温度上昇度は、
「発生した熱量に比例し、溶液の体積に反比例する」
と考えられます。
以上のことより
bの温度上昇度は、aの温度上昇度 × 1/2 × 3/2
となります。
∴ 2℃ × 1/2 × 3/2 = 1.5℃ 答③
フラーレンに関する新手の問題(3)
では、解説と解答を書いてみます。
解説中の価標について、まだ結合していない価標の数を「~手」、2原子間で結合している価標の数を「~本」、と記してあります。
Cから出ている価標の数は4手で、フラーレンC601分子中の60個のC原子から出ている価標の総数は、
4 × 60 = 240手
です。
2つのC原子間の2手の価標がつながって1本の価標になるので、C60分子中の「結合で出来上がっている価標」の数は、
240手/2 = 120本
となります。
一方、前問より、C・C間の結合の総数は、
[5,6結合]60本 +[6,6結合]30本 = 90本
です。
すると、
120-90=30本
この分の価標が余りますね?
この30本分の価標がC・C間の2本目の価標となり、その結果30か所に2重結合が出来るということになる訳です!
以上の結果、単結合が60本、二重結合が30本となりますね。
これでつじつまが合うことを確認して下さい!
フラーレンに関する新手の問題(2)
解説と答えを簡単に書いてみます。
5員環どうしは接しないので、5員環の周りは全て6員環ということになります。
5員環1個の周りには5本の[5,6]結合があり、5員環は12個存在しています。
よって、[5,6]結合の数は、
5本 × 12個 = 60本
また、6員環の周りには6辺あり、20個の6員環の辺の数は
6辺 × 20個 = 120辺
このうち、5員環との結合60本分つまり60辺を除いた分
120辺 ー 60辺 = 60辺
が6員環どうしの結合[6,6]結合の分となります。
2つの6員環の2辺が重なって[6,6]結合が1本出来ると考えれば良いので、
[6,6]結合の数は、
60辺/2 = 30本
となります。
正解は、 1⃣ ③、2⃣ ⓪、3⃣ ⑥、4⃣ ⓪
ですが、3⃣、4⃣ を先に考えた方がいいですね!
さて、どうだったでしょうか?
この問題の続きがもう1問あるので、挑戦してみて下さい!
答えは次回に書きます。
フラーレンに関する新手の問題(訂正)
昨日紹介したフラーレンについての問題ですが、この問題文の前置きの文中に重要な条件が書かれていて、それを抜かしてしまっていました。
すみません!
条件文と合わせて問題文を再度載せます。
フラーレンに関する新手の問題(1)
フラーレンC60分子についての問題を解いてみて下さい。
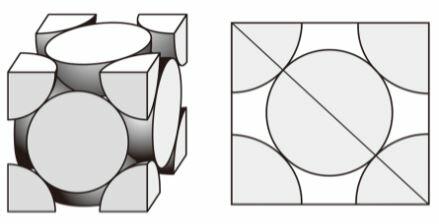
まずは、教科書の例題と同様の問題です。
ここでは、単位格子を構成している粒子は何であっても同じ方法で解けるので、構成粒子がフラーレンであることは関係ありません。
単位格子1辺の √2倍が単位格子の面の対角線の長さになります。
そして、この対角線の長さの4分の1が粒子の半径ということになります。
下の図が分かりやすいでしょう。
∴ 1.41nm × √2 × 1/4 = 0.5nm 答①
さて、新手の問題というのは次の問いです。
考え方と正解は次回に書きますので、ぜひ挑戦してみて下さい!
考え方を提示されれば、「あーそうか!」となると思うんですが、化学の入試問題としては珍しいタイプなので、戸惑うのではないでしょうか?
自分はしばらく悩みました。
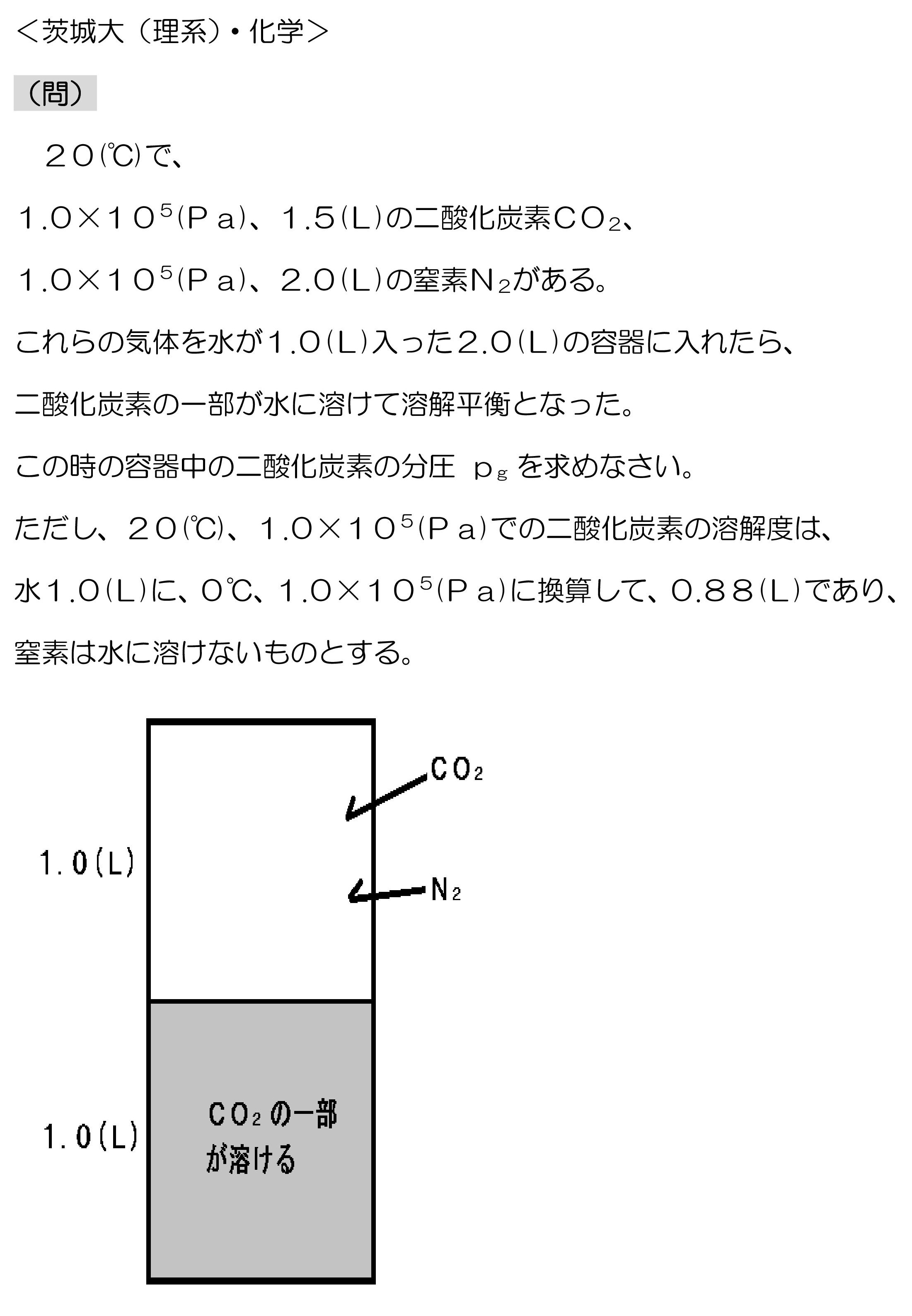
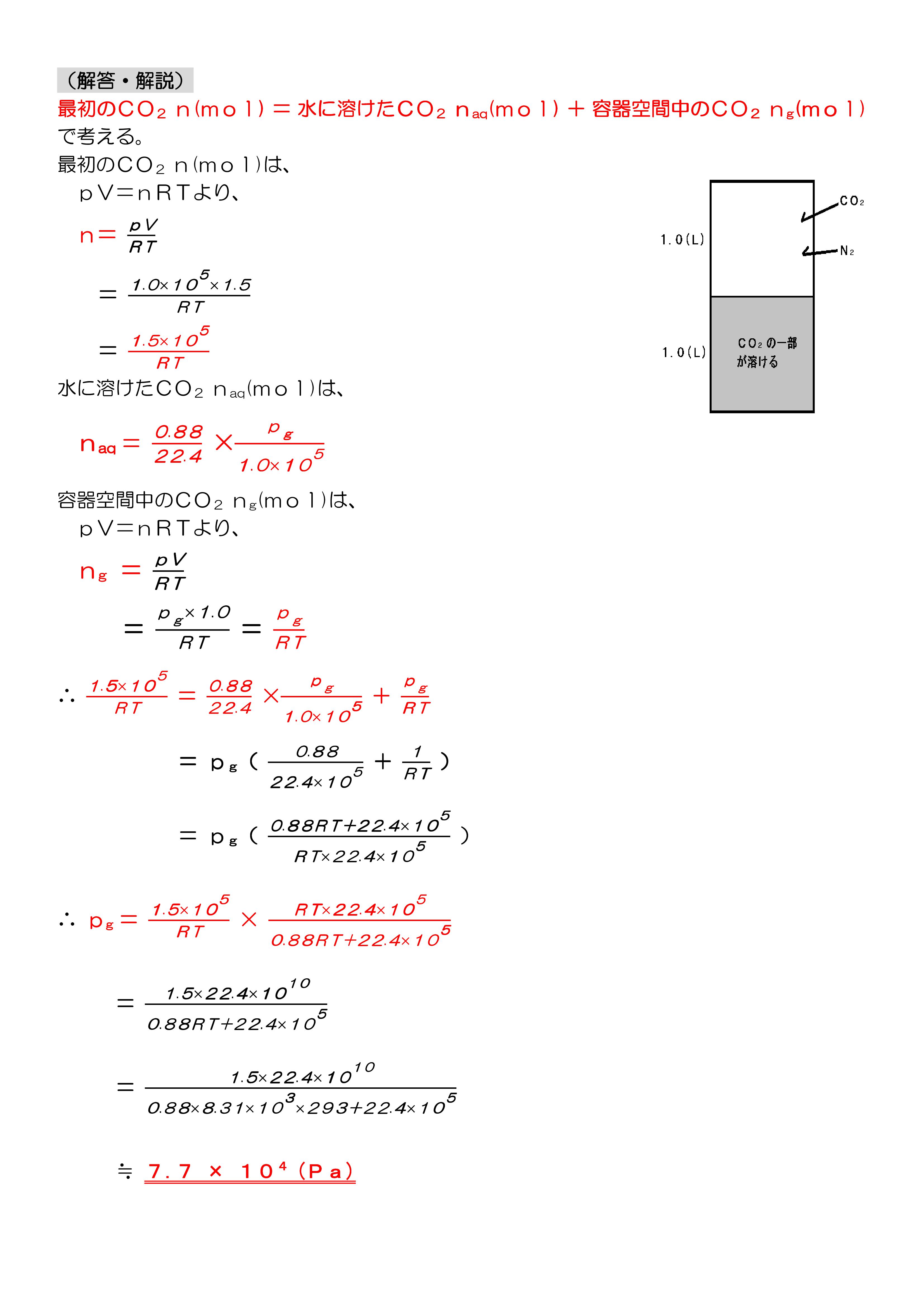
茨城大(理系化学・気体の溶解平衡)記述問題
この問題を解く時、「最初のCO2=水に溶けたCO2+容器空間のCO2」 がすぐに思いつかず、時間がかかってしまいました・・・
この問題では、封入したCO2に対して水に溶けるCO2がかなり多く、水に溶解するCO2の量を除いた分の圧力が容器空間内のCO2の分圧になります。
ここで、水に溶解するCO2の量は容器空間内のCO2の分圧に比例するところが厄介だと思うんですが、
「最初のCO2=水に溶けたCO2+容器空間のCO2」を使えば、式は簡単に作れるということです。
ただし、計算はかなり面倒です。
有効数字3ケタの値で計算していって、最後に有効数字2ケタに丸めなければなりません。
R=8.31×103、T=293(K)を使うので、共通テストのように簡単にはいきませんね。
これは過去問ですが、最近は計算がもっと楽になるようにしてくれていると思うんですが・・・
(ごめんなさい。確証はないんですが)
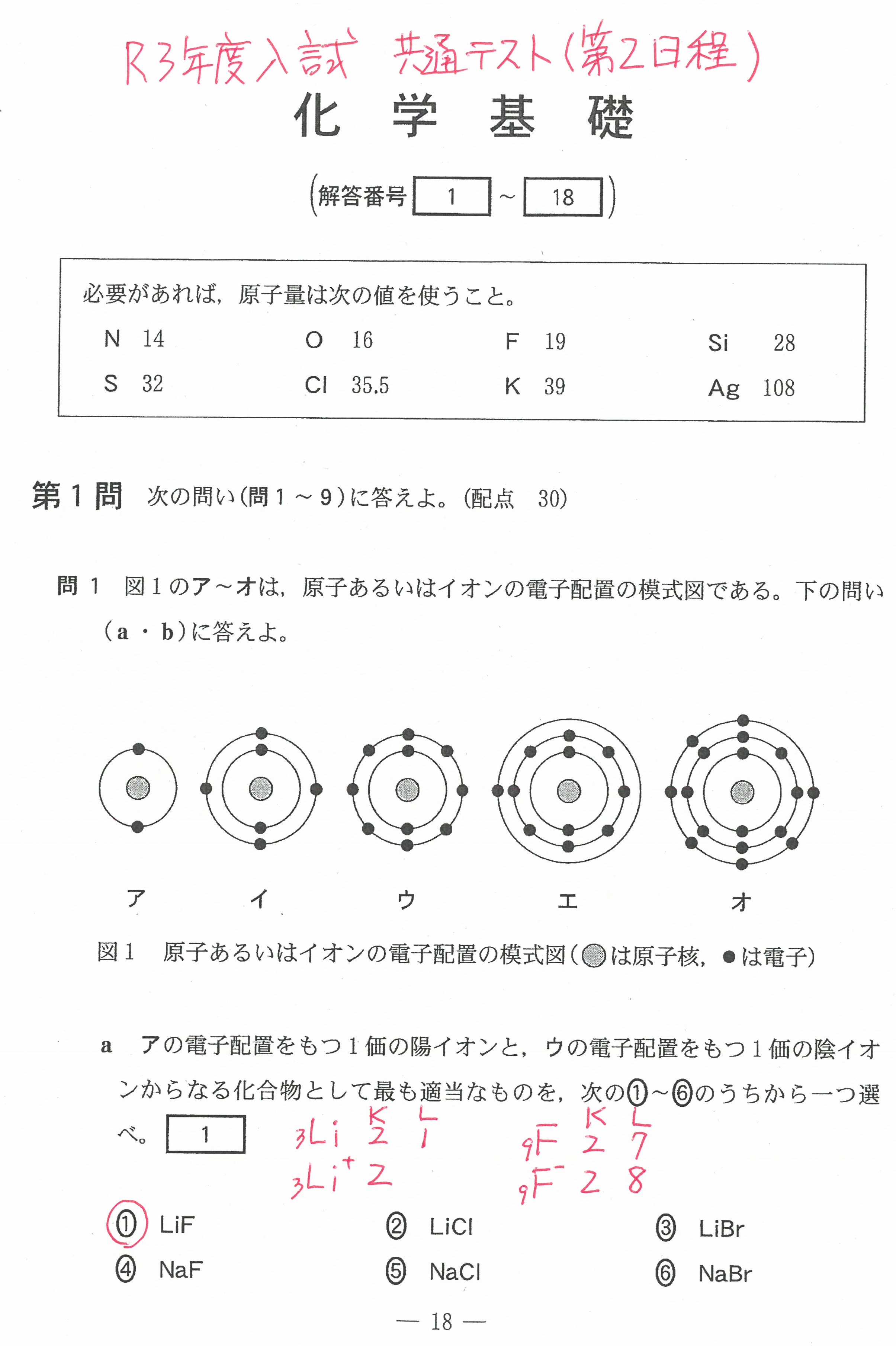
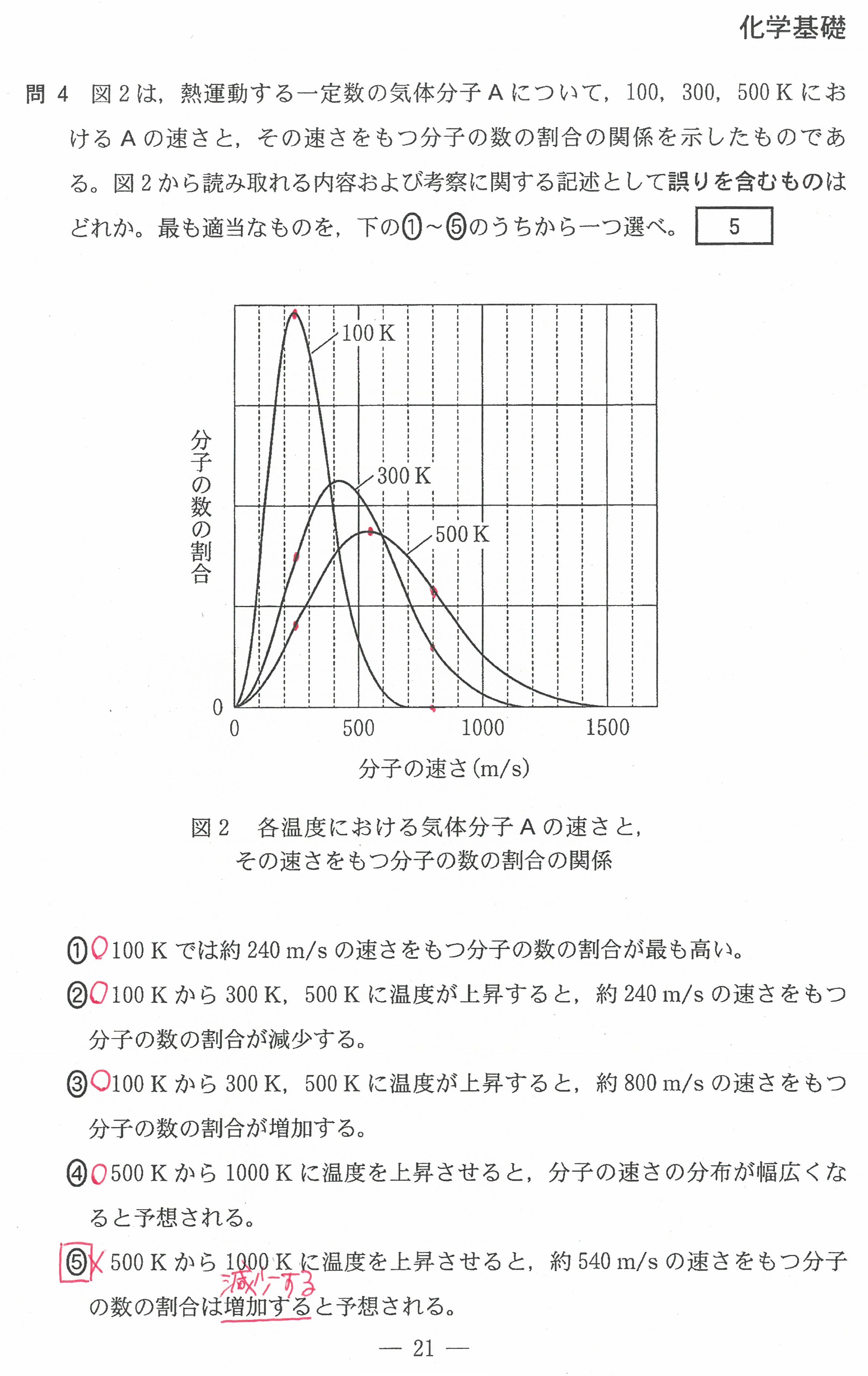
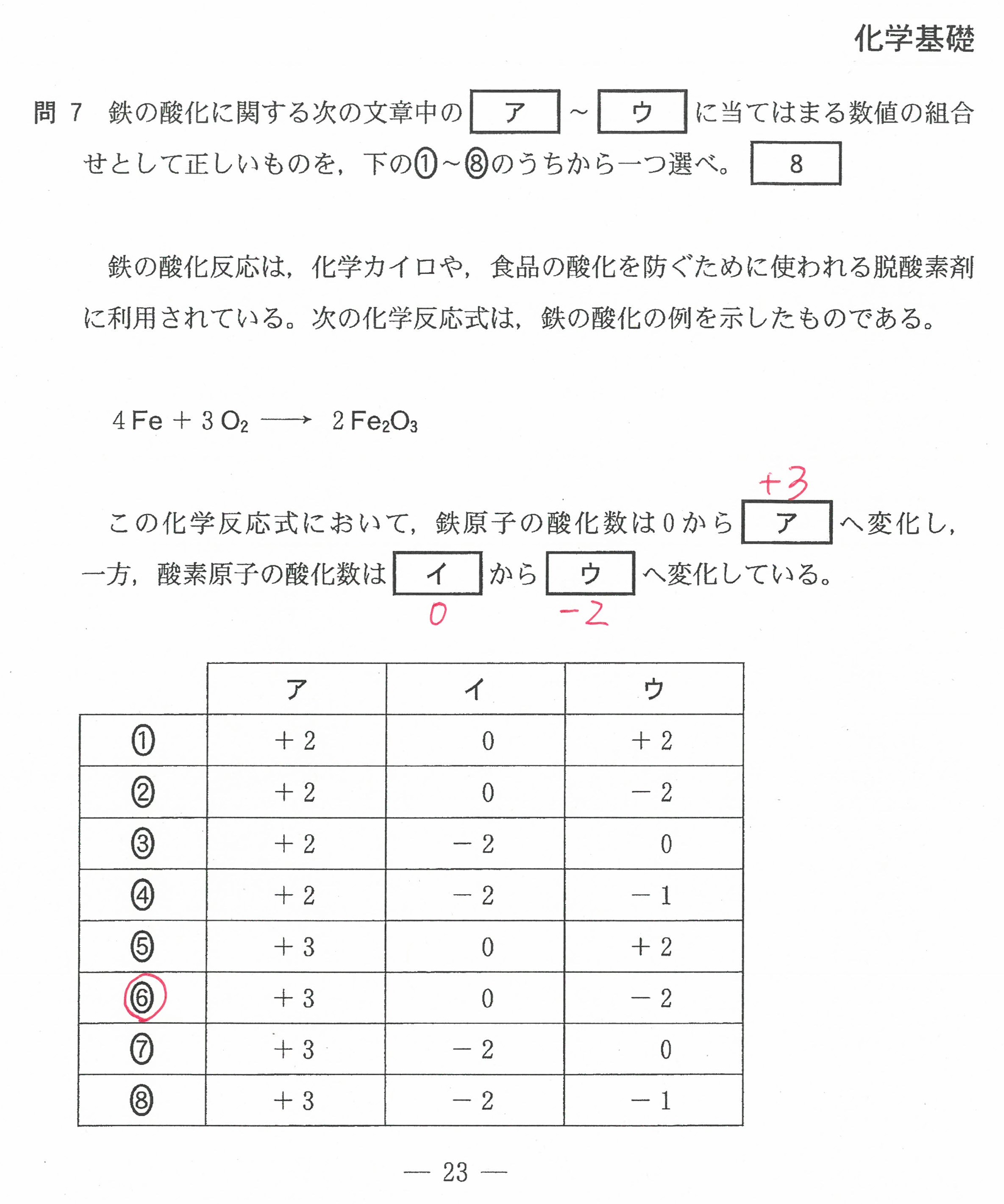
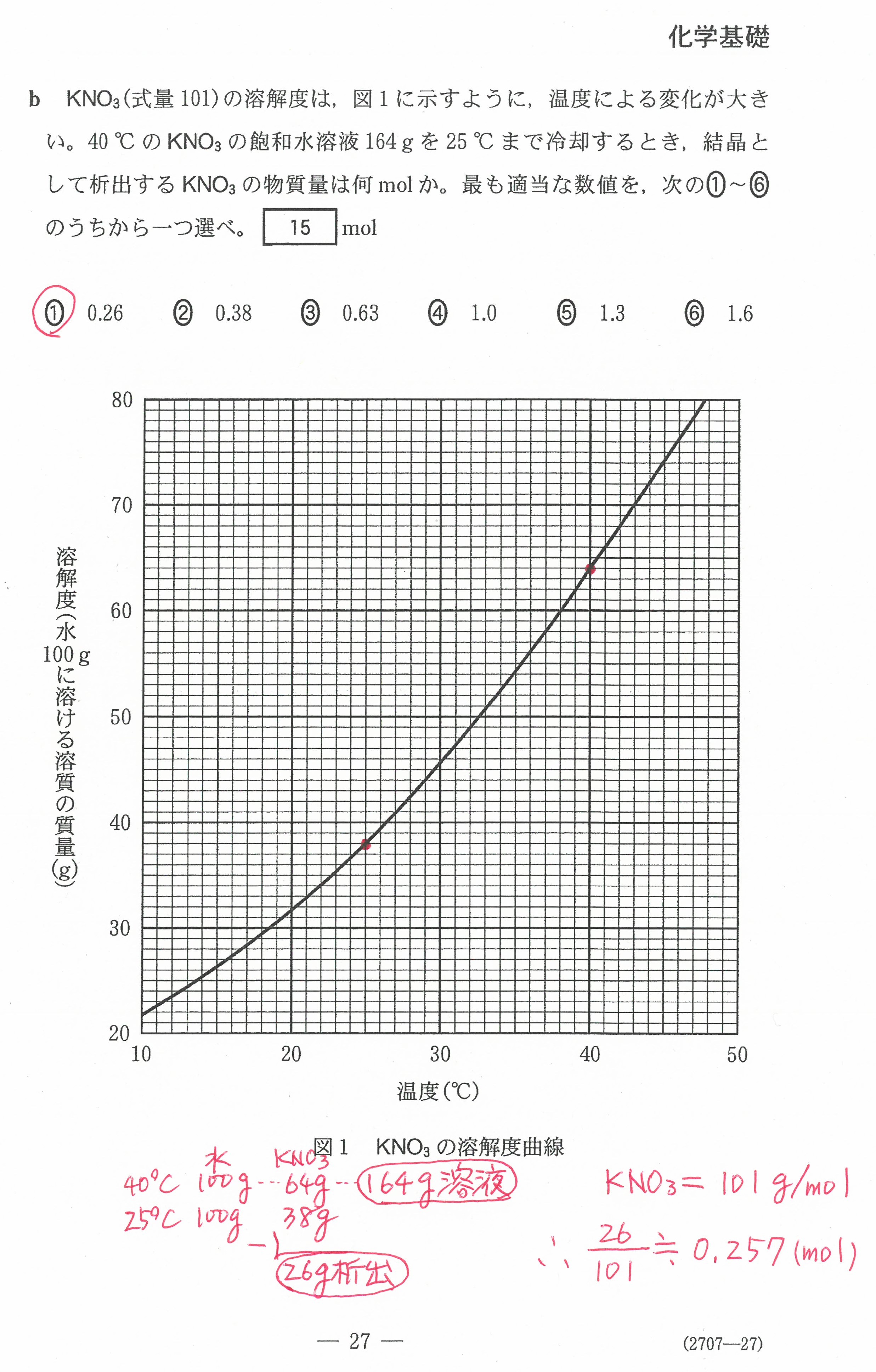
R3年度入学共通テスト第2日程(化学基礎)解答解説
R3年度入学共通テスト第2日程(化学)解答解説
R3年度入学共通テスト(化学基礎)解答解説
R3年度入学共通テスト(化学)解答解説
このウェブサイトは、
NetCommons3.3.7で動いています。
NetCommons プロジェクト 開発の、
CMS+グループウェアです!
| 日 | 月 | 火 | 水 | 木 | 金 | 土 |
28 | 29 | 30 | 1 | 2 | 3 | 4 |
5 | 6 | 7 | 8 | 9 | 10 | 11 |
12 | 13 | 14 | 15 | 16 | 17 | 18 |
19 | 20 | 21 | 22 | 23 | 24 | 25 |
26 | 27 | 28 | 29 | 30 | 31 | 1 |