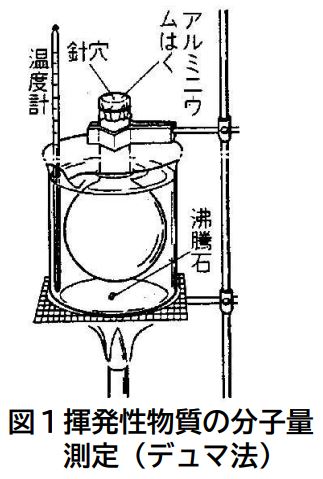
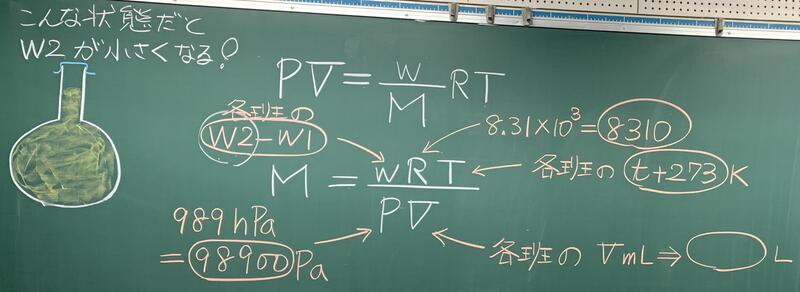揮発性物質の分子量測定 誤差の原因
気体の状態方程式の勉強のあとに、物質の分子量測定という項目が出てきます。
その中で、液体物質の分子量を測定する実験があります。
液体物質を加熱して蒸発させて気体とし、気体となった物質の、質量、温度、圧力を測定します。
この測定値を状態方程式に代入して計算すると、分子量が求められます!
実験装置は以下のようです。
この実験をヘキサンC6H14について、何回かやってみました。
下の写真のようにフラスコの底に液体が確認出来ます。
この状態を目視するのがかなり大変です。
蒸発し切ったかどうかの確認が難しいんです
液体が全て蒸発してから2分ほど温度を変えずに加熱を続けます。
この時の加熱時間は長すぎてもいけません。
下の写真では、液体が蒸発してフラスコ上部で再び液化してフラスコ下部に戻る「還流」が確認出来ますが、
この還流も起こらなくなるまで加熱を続けます。
さて、何回か行った実験の全ての回で、実験値が理論値に対して10~15%ほど小さく出てしまいました。
誤差の原因を何度も考えてみましたが、最もそれらしいと思えたのは、
気体となった物質を捕集する時の失敗です。
① 加熱時間が長すぎた
② 加熱時に一時的に温度が上がり過ぎ、その後温度が下がった
③ アルミ箔のフタの密閉性が悪く、気体が逃げた
これらのいずれもが、気体がフラスコの外に逃げてしまい、気体の測定質量が小さくなってしまう原因になります。
この状態で以下のように計算すると、求まる分子量の値は小さくなってしまいます。
気温が板書してありますが、計算式中で使う温度はフラスコを温める湯の温度(絶対温度)を用います。
フラスコ内部の温度を測るのが理想ですが、出来るだけフラスコの密閉性を保ちたいので難しいでしょう。
このウェブサイトは、
NetCommons3.3.7で動いています。
NetCommons プロジェクト 開発の、
CMS+グループウェアです!
| 日 | 月 | 火 | 水 | 木 | 金 | 土 |
27 1 | 28 1 | 29 | 30 | 31 | 1 | 2 |
3 | 4 | 5 | 6 | 7 | 8 | 9 |
10 | 11 | 12 | 13 | 14 | 15 | 16 |
17 | 18 | 19 | 20 | 21 | 22 | 23 |
24 | 25 | 26 | 27 | 28 | 29 | 30 |